题目内容
【题目】CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法。
I、甲醇可以补充和部分替代石油燃料,缓解能源紧张。利用CO可以合成甲醇。
(1) 已知:CO(g)+1/2O2(g)=CO2(g) △H1=-283.0kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) △H2=-285.8kJ·mol-1
CH3OH(g)+3/2 O2(g)=CO2(g)+2H2O(l) △H3=-764.5kJ·mol-1
则CO(g)+2H2(g)=CH3OH(g) △H=____________kJ·mol-1
(2)一定条件下,在容积为2L的密闭容器中充入1mol CO与2 mol H2合成甲醇 平衡转化率与温度、压强的关系如右图所示。
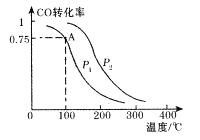
①在2 min时测得容器内甲醇的浓度为0.25 mol·L-1,则0-2 min内CO的平均反应速率为____mol·L-1·min-1,H2的转化率为____。
②由图判断P1_______P2(填“>” 、“<” 或“=” ),理由是____________________________________
③该甲醇合成反应在A点的平衡常数K=____
④下列措施中能够同时满足增大反应速率和提高CO转化率的是____。(填写相 应字母)
A、使用高效催化剂 b、降低反应温度 c、增大体系压强
D、不断将CH3OH从反应混合物中分离出来
Ⅱ、某学习小组以SO2为原料,采用电化学方法制取硫酸。
(3)原电池法:
该小组设计的原电池原理如右图所示。
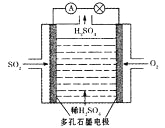
该电池中右侧为________极,写出该电池负极的电极反应式 ____。
(4)电解法:
该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸。原理如右图所示。
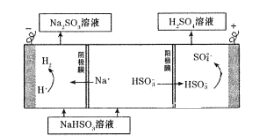
写出开始电解时阳极的电极反应式____________________
【答案】 -90.1 0.125 50% < 甲醇的合成反应是气体分子数减小的反应,相同温度下,增大压强转化率提高 48 C 正 SO2-2e-+2H2O= SO42-+4H+ HSO3--2e-+H2O= SO42-+3H+
【解析】I、(1) 已知:①CO(g)+1/2O2(g)=CO2(g) △H1=-283.0kJ·mol-1
②H2(g)+1/2O2(g)=H2O(l) △H2=-285.8kJ·mol-1
③CH3OH(g)+3/2 O2(g)=CO2(g)+2H2O(l) △H3=-764.5kJ·mol-1
由①+②![]() 2-③得CO(g)+2H2(g)=CH3OH(g) ,所以△H=(-283.0kJ·mol-1)+( -285.8kJ·mol-1)
2-③得CO(g)+2H2(g)=CH3OH(g) ,所以△H=(-283.0kJ·mol-1)+( -285.8kJ·mol-1) ![]() 2-( -764.5kJ·mol-1)= -90.1kJ·mol-1.
2-( -764.5kJ·mol-1)= -90.1kJ·mol-1.
(2)①一定条件下,在容积为2L的密闭容器中充入1mol CO与2 mol H2合成甲醇,则CO与H2的起始浓度分别为0.5mol/L和1mol/L。CO(g)+2H2(g)=CH3OH(g),在2 min时测得容器内甲醇的浓度为0.25 mol·L-1。由化学方程式可知, 0-2 min内CO浓度的变化量与甲醇相同,则用CO表示的平均反应速率为![]() =0.125mol·L-1·min-1。反应物的投料比与化学计量为数之比相同,所以H2的转化率与CO相同,均为
=0.125mol·L-1·min-1。反应物的投料比与化学计量为数之比相同,所以H2的转化率与CO相同,均为![]() .
.
②由图判断P1<P2理由是甲醇的合成反应是气体分子数减小的反应,相同温度下,增大压强转化率提高。
③由图像可知,该甲醇合成反应中CO的转化率在A点为0.75,CO与H2、甲醇的浓度变化量分别为0.375mol/L和0.75mol/L、0.375mol/L,CO与H2的平衡浓度分别为0.125mol/L和0.25mol/L,平衡常数K=![]() 48.
48.
④增大体系压强能够同时满足增大反应速率和提高CO转化率,选C。
Ⅱ、(3)由图中信息可知,左侧二氧化硫发生氧化反应生成硫酸根,右侧氧气发生还原反应生成水,总反应为2SO2+O2+2H2O=2H2SO4。因此,该电池中右侧为正极,该电池负极的电极反应式为SO2-2e-+2H2O= SO42-+4H+。
(4)由图中信息可知,在阳极室中,硫酸氢根被氧化为硫酸根离子;在阴极室中,氢离子放电生成氢气发生还原反应。所以,开始电解时阳极的电极反应式HSO3--2e-+H2O= SO42-+3H+。

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案【题目】某兴趣小组研究亚硝酸钠,查阅下列资料,试根据信息回答下列问题。
药品 | NaNO2(亚硝酸钠) |
性质 | 1.在酸性溶液中有较强氧化性,能将Fe2+氧化成Fe3+; 2.AgNO2是一种难溶于水、易溶于酸的盐。 |
(1)已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。请用双线桥表示电子转移的方向和数目。________________
该反应中氧化剂是_____;若有0.75mol电子转移,则被还原的氧化剂粒子数为_______。
(2)误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列分析错误的是______(填序号)。
A.NaNO2被还原 B.维生素C具有还原性
C.还原性:维生素C>Fe2+ D.NaNO2是还原剂
(3)下列方法中,可用来区分NaNO2和NaCl的是______ (填序号)。
A. 焰色反应 B.分别滴加酸化FeSO4溶液和KSCN溶液
C.在酸性条件下加入KI淀粉溶液 D.分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:_______________。
【题目】某兴趣小组同学在实验室用加热l﹣丁醇、浓H2SO4和溴化钠混合物的方法来制备1﹣溴丁烷,设计了如下图所示的实验装置(其中的夹持仪器没有画出). 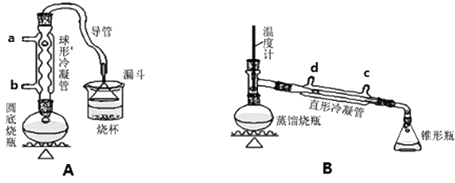
请回答下列问题:
(1)A装置中,在烧杯里的液面倒扣一个漏斗,其目的是 . 两个装置中都用到了冷凝管,A装置中冷水从(填字母代号)进入,B装置中冷水从(填字母代号)进入.
(2)制备操作中,加入的浓硫酸事先必须进行稀释,其目的是 . (填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成 c.水是反应的催化剂
(3)有同学拟通过红外光谱仪鉴定所得产物中是否含有“﹣CH2CH2CH2CH3”,来确定副产物中是否存在丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3).请评价该同学设计的鉴定方案是否合理?为什么?答: .
(4)为了进一步提纯1﹣溴丁烷,该小组同学查得相关有机物的有关数据如下表:
物质 | 熔点/℃ | 沸点/℃ |
1﹣丁醇 | ﹣89.5 | 117.3 |
1﹣溴丁烷 | ﹣112.4 | 101.6 |
丁醚 | ﹣95.3 | 142.4 |
1﹣丁烯 | ﹣185.3 | ﹣6.5 |
则用B装置完成此提纯实验时,实验中要迅速升高温度至收集所得馏分.