题目内容
【题目】高氯酸铵(NH4ClO4)常作火箭发射的推进剂。已知NH4ClO4在400℃时开始分解。某课题组设计实验探究NH4ClO4的分解产物(假设装置内药品均足量)。
(1)甲同学设计如图实验(部分夹持装置已省略):
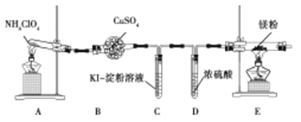
①若高氯酸铵分解有氯气生成,则可能观察到的现象是 ,写出产生该现象的离子方程式 。
②实验完毕后,取出E中硬质玻璃管中固体于试管中,滴加蒸馏水,产生的气体R能使红色湿润的石蕊试纸变蓝色。R的电子式为 。硬质玻璃管中固体与水反应放出R的化学方程式为 。
(2)乙同学认为,A中可能产生O2。为了验证他的猜想,选择上述部分装置和下列提供的装置进行实验:
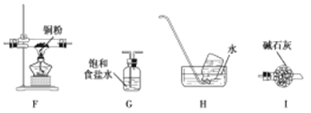
①按气流从左至右,装置的连接顺序为 。
②能说明有氧气的现象是 。
(3)通过查阅资料:NH4ClO4在℃时的分解产物为N2、Cl2、O2、H2O,写出高氯酸铵分解的化学方程式 。
【答案】
(1)①C中溶液变蓝色;Cl2+2I-=2Cl-+I2;
②![]() ;Mg3N2+6H2O=3Mg(OH)2+2NH3↑;
;Mg3N2+6H2O=3Mg(OH)2+2NH3↑;
(2)①A、I、F、H;②F中红色粉末变黑色;
(3)2NH4ClO4![]() N2↑+2O2↑+Cl2↑+4H2O;
N2↑+2O2↑+Cl2↑+4H2O;
【解析】
试题分析:(1)①高氯酸铵分解有氯气生成,氯气能够置换出碘,碘遇淀粉变蓝色,反应的离子方程式为Cl2+2I-=2Cl-+I2,故答案为:C中溶液变蓝色;Cl2+2I-=2Cl-+I2;
②气体R能使红色湿润的石蕊试纸变蓝色,R为氨气,氨气的电子式为![]() ,说明硬质玻璃管中固体为Mg3N2,Mg3N2与水反应放出氨气的化学方程式为Mg3N2+6H2O=3Mg(OH)2+2NH3↑,故答案为:
,说明硬质玻璃管中固体为Mg3N2,Mg3N2与水反应放出氨气的化学方程式为Mg3N2+6H2O=3Mg(OH)2+2NH3↑,故答案为:![]() ;Mg3N2+6H2O=3Mg(OH)2+2NH3↑;
;Mg3N2+6H2O=3Mg(OH)2+2NH3↑;
(2)①根据上述发现,A中可能生成氮气,氯气,水蒸气,氧气,因此需要用碱石灰除去氯气和水蒸气,再通入铜粉,看铜粉是否变黑,故答案为:A、I、F、H;
②能说明有氧气的现象是F中红色粉末变黑色,故答案为:F中红色粉末变黑色;
(3)NH4ClO4在℃时的分解产物为N2、Cl2、O2、H2O,高氯酸铵分解的化学方程式为2NH4ClO4![]() N2↑+2O2↑+Cl2↑+4H2O,故答案为:2NH4ClO4
N2↑+2O2↑+Cl2↑+4H2O,故答案为:2NH4ClO4![]() N2↑+2O2↑+Cl2↑+4H2O;
N2↑+2O2↑+Cl2↑+4H2O;

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案【题目】只给出下列甲和乙中对应的物理量,不能求出物质的量的是( )
A | B | C | D | |
甲 | 物质中的粒子数 | 标准状况下的气体摩尔体积 | 固体的体积 | 溶液中溶质的物质的量浓度 |
乙 | 阿伏加德罗常数 | 标准状况下的气体的体积 | 固体的密度 | 溶液体积 |