题目内容
(1) 纳米级Cu2O由于具有优良的催化性能而受到关注。已知:
2Cu(s)+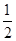 O2(g) ="==" Cu2O(s) ΔH=-169kJ·mol-1,
O2(g) ="==" Cu2O(s) ΔH=-169kJ·mol-1,
C(s)+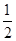 O2(g) ="==" CO(g) ΔH=-110.5kJ·mol-1,
O2(g) ="==" CO(g) ΔH=-110.5kJ·mol-1,
2Cu(s)+ O2(g)===2 CuO(s) ΔH=-314kJ·mol-1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为
。
(2)某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。

请回答下列问题:
(1)甲池为 (填“原电池”、“电解池”或 “电镀池”),A电极的电极反应式为 。
(2)丙池中F电极为 (填“正极”、“负极”、“阴极”或“阳极”),该池的总反应方程式为 。
(3)当池中C极质量减轻10.8 g时,甲池中B电极理论上消耗O2的体积为 mL(标准状况)。
(4)一段时间后,断开电键K,下列物质能使乙池恢复到反应前浓度的是 (填选项字母)。
2Cu(s)+
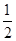 O2(g) ="==" Cu2O(s) ΔH=-169kJ·mol-1,
O2(g) ="==" Cu2O(s) ΔH=-169kJ·mol-1,C(s)+
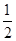 O2(g) ="==" CO(g) ΔH=-110.5kJ·mol-1,
O2(g) ="==" CO(g) ΔH=-110.5kJ·mol-1,2Cu(s)+ O2(g)===2 CuO(s) ΔH=-314kJ·mol-1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为
。
(2)某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。

请回答下列问题:
(1)甲池为 (填“原电池”、“电解池”或 “电镀池”),A电极的电极反应式为 。
(2)丙池中F电极为 (填“正极”、“负极”、“阴极”或“阳极”),该池的总反应方程式为 。
(3)当池中C极质量减轻10.8 g时,甲池中B电极理论上消耗O2的体积为 mL(标准状况)。
(4)一段时间后,断开电键K,下列物质能使乙池恢复到反应前浓度的是 (填选项字母)。
| A.Cu | B.CuO | C.Cu(OH)2 | D.Cu2(OH)2CO3 |
(1)C(s) + 2CuO (s)= Cu2O(s) + CO(g) 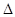 H =+34.5kJ·mol.-1(3分)
H =+34.5kJ·mol.-1(3分)
(2)①原电池 (1分) CH3OH + 8OH--6e- = CO32-+ 6H2O(2分)
②阴极(1分) 2CuSO4+ 2H2O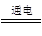 2H2SO4 + 2Cu + O2↑(2分)
2H2SO4 + 2Cu + O2↑(2分)
③560(2分)
④A(2分)
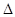 H =+34.5kJ·mol.-1(3分)
H =+34.5kJ·mol.-1(3分)(2)①原电池 (1分) CH3OH + 8OH--6e- = CO32-+ 6H2O(2分)
②阴极(1分) 2CuSO4+ 2H2O
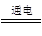 2H2SO4 + 2Cu + O2↑(2分)
2H2SO4 + 2Cu + O2↑(2分)③560(2分)
④A(2分)
试题分析:(1)工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为
C(s) + 2CuO (s)= Cu2O(s) + CO(g)
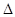 H =a,
H =a,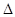 H 的计算如下,C(s)+
H 的计算如下,C(s)+ 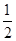 O2(g) ="==" CO(g) 减去2Cu(s)+ O2(g)===2 CuO(s) 再加上2Cu(s)+
O2(g) ="==" CO(g) 减去2Cu(s)+ O2(g)===2 CuO(s) 再加上2Cu(s)+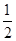 O2(g) ="==" Cu2O(s) 可以得到C(s) + 2CuO (s)= Cu2O(s) + CO(g) ,所以
O2(g) ="==" Cu2O(s) 可以得到C(s) + 2CuO (s)= Cu2O(s) + CO(g) ,所以 H =-110.5+314-169=+34.5kJ·mol.-1,所以工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为
H =-110.5+314-169=+34.5kJ·mol.-1,所以工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为C(s) + 2CuO (s)= Cu2O(s) + CO(g)
 H =+34.5kJ·mol.-1;
H =+34.5kJ·mol.-1;(1)由图可以知道,甲池为原电池,A电极为负极,该电极反应式为CH3OH + 8OH--6e- = CO32-+ 6H2O;(2)丙池中F电极与电池的负极连接,所以F电极为阴极,丙电池为电解池,该电池的总的反应式为2CuSO4+ 2H2O
 2H2SO4 + 2Cu + O2↑;(3)C极中,Ag溶解,所以当池中C极质量减轻10.8 g时,即通过的电子数为10.8/108=0.1mol,所以B电极理论上消耗O2的体积=0.1/4×22.4×1000=560mL;(4)一段时间后,断开电键K,乙池在电解的过程中引入了银离子,有一部分铜离子在电极上析出,所以加入Cu可以恢复到原来的浓度,故本题的答案选择A。
2H2SO4 + 2Cu + O2↑;(3)C极中,Ag溶解,所以当池中C极质量减轻10.8 g时,即通过的电子数为10.8/108=0.1mol,所以B电极理论上消耗O2的体积=0.1/4×22.4×1000=560mL;(4)一段时间后,断开电键K,乙池在电解的过程中引入了银离子,有一部分铜离子在电极上析出,所以加入Cu可以恢复到原来的浓度,故本题的答案选择A。点评:本题考查了热化学方程式的书写、原电池、电解池,这些考点是高考考查的重点和难点,本题有一定的综合性,难度适中。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
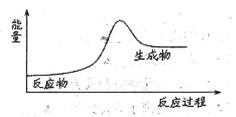
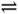 2NH3(g) △H=-38.6kJ·mol-1
2NH3(g) △H=-38.6kJ·mol-1
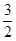 O2(g);△H="+765.2" kJ·mol-1,请在答题卡的坐标图中,画出上述反应过程中体系能量变化示意图,并进行必要标注。
O2(g);△H="+765.2" kJ·mol-1,请在答题卡的坐标图中,画出上述反应过程中体系能量变化示意图,并进行必要标注。