题目内容
已知A、B均是由两种短周期元素组成的化合物,A中某元素的质量分数为75%,C、J是同周期元素的气态氢化物,X为无色液体,D具有两性.反应生成的水均已略去.它们有如下图所示的关系.
(1)写出化学式:A.______,B.______,C.______.
(2)反应③中每生成lmolF,转移电子的数目为:______.
(3)反应④的化学方程式为:______△4NO+6H2O
【答案】分析:1.X为无色液体,推断X为H2O;
2.D具有两性,可知D为Al2O3或Al(OH)3,而Al2O3要经过氢氧化铝脱水或铝直接与氧气化合而得,图中显然不具备这样的条件,因此D为Al(OH)3,D由A反应而来,A中含铝元素;
3.因为D遇I溶解,可知I为强酸或强碱,但I由J一路反应而来,又有J为第二周期元素的气态氢化物,因此J为非金属氢化物,I为强酸,而L+X生成I+K,只有硝酸的生成(3NO2+H2O=2HNO3+NO)符合这一模式,I为HNO3;L为NO2,K为NO,由NO+F到NO2,F为O2.顺便也可知J中含氮元素,J为NH3;
4.因为C也为第二周期元素的气态氢化物,而第二周期元素的气态氢化物一般只研究碳与氮元素的氢化物(若C为HF,则A为AlF3,不合题意;而硼的性质一般不做研究,否则要给提示或条件),J为NH3,所以C为烃类,A为碳与铝的化合物,结合给出的质量分数,A为Al4C3,它与水发生水解反应时,碳元素的价态不变,因此产物C为甲烷(CH4),它与F(氧气)反应除水之外的产物H为CO2.A+X=C+D反应方程式:Al4C3+12H2O→4Al(OH)3+3CH4↑;
5.因为H与G反应生成D(Al(OH)3),G由D反应来,因此G为偏铝酸盐,E为强碱,因为E由短周期元素化合物B与水反应来,所以E为NaOH,G为NaAlO2,因为B+水生成NaOH+O2,所以B为Na2O2.依据推断物质分析回答问题.
解答:解:1.X为无色液体,推断X为H2O;
2.D具有两性,可知D为Al2O3或Al(OH)3,而Al2O3要经过氢氧化铝脱水或铝直接与氧气化合而得,图中显然不具备这样的条件,因此D为Al(OH)3,D由A反应而来,A中含铝元素;
3.因为D遇I溶解,可知I为强酸或强碱,但I由J一路反应而来,又有J为第二周期元素的气态氢化物,因此J为非金属氢化物,I为强酸,而L+X生成I+K,只有硝酸的生成(3NO2+H2O=2HNO3+NO)符合这一模式,L为NO2,K为NO,由NO+F到NO2,F为O2.顺便也可知J中含氮元素,J为NH3;
4.因为C也为第二周期元素的气态氢化物,而第二周期元素的气态氢化物一般只研究碳与氮元素的氢化物(若C为HF,则A为AlF3,不合题意;而硼的性质一般不做研究,否则要给提示或条件),J为NH3,所以C为烃类,A为碳与铝的化合物,结合给出的质量分数,A为Al4C3,它与水发生水解反应时,碳元素的价态不变,因此产物C为甲烷(CH4),它与F(氧气)反应除水之外的产物H为CO2.A+X=C+D反应方程式:Al4C3+12H2O→4Al(OH)3+3CH4↑;
5.因为H与G反应生成D(Al(OH)3),G由D反应来,因此G为偏铝酸盐,E为强碱,因为E由短周期元素化合物B与水反应来,所以E为NaOH,G为NaAlO2,因为B+水生成NaOH+O2,所以B为Na2O2.综上所述判断出的各物质为:A为Al4C3 ;B为Na2O2;C为CH4;D为Al(OH)3;E为NaOH;F为O2;G为NaAlO2;H为CO2;I为HNO3;为NH3;K为NO;LNO2;X为H2O;
(1)依据分析推断得到A、B、C分别为:Al4C3、Na2O2、CH4,故答案为:Al4C3;Na2O2;CH4;
(2)反应③为2Na2O2+2H2O=4NaOH+O2;反应中过氧化钠自身氧化还原反应,氧元素化合价从-1价变化为0价,-2价,反应中每生成lmolF(O2)转移电子物质的量为2mol,转移电子数为1.204×1024,故答案为:1.204×1024;
(3)反应④是氨气的催化氧化反应,反应的化学方程式为:4NH3+5O2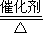 4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2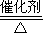 4NO+6H2O;
4NO+6H2O;
(4)反应②是二氧化碳气体通入偏铝酸钠溶液中发生的反应,反应的离子方程式为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-或AlO2-+CO2+2H2O=2Al(OH)3↓+HCO3-;反应⑤是氢氧化铝在硝酸中溶解的反应,反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O,
故答案为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-或AlO2-+CO2+2H2O=2Al(OH)3↓+HCO3-;Al(OH)3+3H+=Al3++3H2O;
(5)反应①是甲烷燃烧生成二氧化碳和水的反应,每1.00g CH4与足量的F(O2)作用,恢复到25℃水为液体,放出55.6kJ热量;依据化学方程式计算1mol甲烷燃烧放热为889.6KJ;
反应的热化学方程式为:CH4(g)+2O2(g)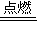 CO2(g)+2H2O(l)△H=-889.6kJ?mol-1,
CO2(g)+2H2O(l)△H=-889.6kJ?mol-1,
故答案为:CH4(g)+2O2(g)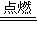 CO2(g)+2H2O(l)△H=-889.6kJ?mol-1.
CO2(g)+2H2O(l)△H=-889.6kJ?mol-1.
点评:本题考查了物质转化关系的分析判断,物质性质的应用,反应现象的分析,化学方程式、离子方程式、热化学方程式的书写方法和计算应用,物质性质的分析,现象的推断是解题关键.题目难度中等.
2.D具有两性,可知D为Al2O3或Al(OH)3,而Al2O3要经过氢氧化铝脱水或铝直接与氧气化合而得,图中显然不具备这样的条件,因此D为Al(OH)3,D由A反应而来,A中含铝元素;
3.因为D遇I溶解,可知I为强酸或强碱,但I由J一路反应而来,又有J为第二周期元素的气态氢化物,因此J为非金属氢化物,I为强酸,而L+X生成I+K,只有硝酸的生成(3NO2+H2O=2HNO3+NO)符合这一模式,I为HNO3;L为NO2,K为NO,由NO+F到NO2,F为O2.顺便也可知J中含氮元素,J为NH3;
4.因为C也为第二周期元素的气态氢化物,而第二周期元素的气态氢化物一般只研究碳与氮元素的氢化物(若C为HF,则A为AlF3,不合题意;而硼的性质一般不做研究,否则要给提示或条件),J为NH3,所以C为烃类,A为碳与铝的化合物,结合给出的质量分数,A为Al4C3,它与水发生水解反应时,碳元素的价态不变,因此产物C为甲烷(CH4),它与F(氧气)反应除水之外的产物H为CO2.A+X=C+D反应方程式:Al4C3+12H2O→4Al(OH)3+3CH4↑;
5.因为H与G反应生成D(Al(OH)3),G由D反应来,因此G为偏铝酸盐,E为强碱,因为E由短周期元素化合物B与水反应来,所以E为NaOH,G为NaAlO2,因为B+水生成NaOH+O2,所以B为Na2O2.依据推断物质分析回答问题.
解答:解:1.X为无色液体,推断X为H2O;
2.D具有两性,可知D为Al2O3或Al(OH)3,而Al2O3要经过氢氧化铝脱水或铝直接与氧气化合而得,图中显然不具备这样的条件,因此D为Al(OH)3,D由A反应而来,A中含铝元素;
3.因为D遇I溶解,可知I为强酸或强碱,但I由J一路反应而来,又有J为第二周期元素的气态氢化物,因此J为非金属氢化物,I为强酸,而L+X生成I+K,只有硝酸的生成(3NO2+H2O=2HNO3+NO)符合这一模式,L为NO2,K为NO,由NO+F到NO2,F为O2.顺便也可知J中含氮元素,J为NH3;
4.因为C也为第二周期元素的气态氢化物,而第二周期元素的气态氢化物一般只研究碳与氮元素的氢化物(若C为HF,则A为AlF3,不合题意;而硼的性质一般不做研究,否则要给提示或条件),J为NH3,所以C为烃类,A为碳与铝的化合物,结合给出的质量分数,A为Al4C3,它与水发生水解反应时,碳元素的价态不变,因此产物C为甲烷(CH4),它与F(氧气)反应除水之外的产物H为CO2.A+X=C+D反应方程式:Al4C3+12H2O→4Al(OH)3+3CH4↑;
5.因为H与G反应生成D(Al(OH)3),G由D反应来,因此G为偏铝酸盐,E为强碱,因为E由短周期元素化合物B与水反应来,所以E为NaOH,G为NaAlO2,因为B+水生成NaOH+O2,所以B为Na2O2.综上所述判断出的各物质为:A为Al4C3 ;B为Na2O2;C为CH4;D为Al(OH)3;E为NaOH;F为O2;G为NaAlO2;H为CO2;I为HNO3;为NH3;K为NO;LNO2;X为H2O;
(1)依据分析推断得到A、B、C分别为:Al4C3、Na2O2、CH4,故答案为:Al4C3;Na2O2;CH4;
(2)反应③为2Na2O2+2H2O=4NaOH+O2;反应中过氧化钠自身氧化还原反应,氧元素化合价从-1价变化为0价,-2价,反应中每生成lmolF(O2)转移电子物质的量为2mol,转移电子数为1.204×1024,故答案为:1.204×1024;
(3)反应④是氨气的催化氧化反应,反应的化学方程式为:4NH3+5O2
 4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2 4NO+6H2O;
4NO+6H2O;(4)反应②是二氧化碳气体通入偏铝酸钠溶液中发生的反应,反应的离子方程式为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-或AlO2-+CO2+2H2O=2Al(OH)3↓+HCO3-;反应⑤是氢氧化铝在硝酸中溶解的反应,反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O,
故答案为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-或AlO2-+CO2+2H2O=2Al(OH)3↓+HCO3-;Al(OH)3+3H+=Al3++3H2O;
(5)反应①是甲烷燃烧生成二氧化碳和水的反应,每1.00g CH4与足量的F(O2)作用,恢复到25℃水为液体,放出55.6kJ热量;依据化学方程式计算1mol甲烷燃烧放热为889.6KJ;
反应的热化学方程式为:CH4(g)+2O2(g)
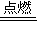 CO2(g)+2H2O(l)△H=-889.6kJ?mol-1,
CO2(g)+2H2O(l)△H=-889.6kJ?mol-1,故答案为:CH4(g)+2O2(g)
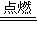 CO2(g)+2H2O(l)△H=-889.6kJ?mol-1.
CO2(g)+2H2O(l)△H=-889.6kJ?mol-1.点评:本题考查了物质转化关系的分析判断,物质性质的应用,反应现象的分析,化学方程式、离子方程式、热化学方程式的书写方法和计算应用,物质性质的分析,现象的推断是解题关键.题目难度中等.

练习册系列答案
相关题目




