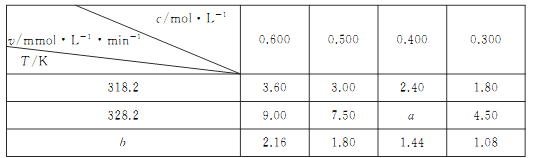
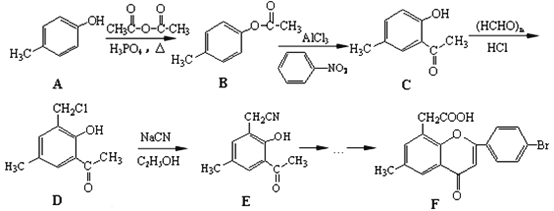
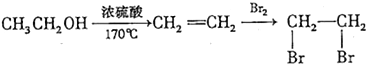题目内容
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是________。
(2)烧杯间填满碎纸条的作用是_______________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值__________(填“偏大、偏小、无影响”)。
(4)实验中改用60 mL 0.50 mol·L-1的盐酸跟50 mL 0.55 mol·L-1的NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”或“不相等”),所求中和热_____________ (填“相等”或“不相等”)。
(5)此反应中和热的热化学方程式为:________________________________________。
【答案】 环形玻璃搅拌棒 减少实验过程中的热量损失 偏小 不相等 相等 NaOH(aq)+HCl(aq) = NaCl(aq)+H2O(l) ΔH= -57.3 kJ/mol
【解析】(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒。(2)实验过程中尽可能减少热量的损失,因此烧杯间填满碎纸条的作用是减少实验过程中的热量损失。(3)大烧杯上如不盖硬纸板,热量散失,求得的中和热数值偏小。(4)如果实验中改用60 mL0.50 mol·L-1的盐酸跟50mL 0.55 mol·L-1的NaOH溶液进行反应,与上述实验相比,生成水的物质的量增加,所放出的热量不相等;中和热是强酸、强碱生成1mol水所对应的反应热,因此所求中和热相等。(5)表示中和热的热化学方程式为NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)ΔH=-57.3 kJ/mol。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案