��Ŀ����
����Ŀ����X��Y��Z����Ԫ�آ�X��Y��Z�ĵ����ڳ����¾�Ϊ���壻��X���ʿ�����Z������ȼ�գ�������ΪXZ�����л���Ϊ��ɫ����XZ��������ˮ�������X+��Z������ˮ��Һ��ʹ��ɫʯ����Һ��죻��ÿ2��X2���ӿ���1��Y2���ӻ�������2��X2Y���ӣ�X2Y�ڳ�����ΪҺ�壻��Z��������X2Y��������Һ����Ư�����á�
��1���ƶ�Ԫ�ط���X_____��Y_____��Z_____��
��2��������XZ�ĵ���ʽΪ_____��X2Y����_____�������ӻ�������ۻ�������۷��ӣ���
��3��д��XZ��д��ѧʽ���ĵ��뷽��ʽ_____��д��XZ��д��ѧʽ����Ca(ClO)2��Ӧ�Ļ�ѧ����ʽ_____��
���𰸡�H O Cl ![]() ���ۻ����� HCl=H++Cl- Ca(ClO)2+2HCl=2HClO+CaCl2
���ۻ����� HCl=H++Cl- Ca(ClO)2+2HCl=2HClO+CaCl2
��������
��X��Y��Z����Ԫ�أ��ɢ�X��Y��Z�ĵ����ڳ����¾�Ϊ���塢��X�ĵ�����Z�ĵ�����ȼ�գ�����XZ��ȼ��ʱ����ʲ�ɫ����XZ��������ˮ����ˮ��Һ�е����X+��Z����XZ��ˮ��Һ��ʹʯ����Һ����֪��XΪH��ZΪCl��XZΪHCl���ɢ�������X�ĵ��ʿ���һ����Y�ĵ��ʻ�������������X2Y��X2Y������ΪҺ�壬��YΪO��X2YΪH2O����X2YΪH2O��Cl2����H2O�У���Ӧ����HCl��HClO��HClO����Ư�����ã������Ϸ������н��
��X��Y��Z����Ԫ�أ��ɢ�X��Y��Z�ĵ����ڳ����¾�Ϊ���塢��X�ĵ�����Z�ĵ�����ȼ�գ�����XZ��ȼ��ʱ����ʲ�ɫ����XZ��������ˮ����ˮ��Һ�е����X+��Z����XZ��ˮ��Һ��ʹʯ����Һ����֪��XΪH��ZΪCl��XZΪHCl���ɢ�������X�ĵ��ʿ���һ����Y�ĵ��ʻ�������������X2Y��X2Y������ΪҺ�壬��YΪO��X2YΪH2O����X2YΪH2O��Cl2����H2O�У���Ӧ����HCl��HClO��HClO����Ư�����ã�
��1�����ݷ�����֪��XΪH��YΪO��ZΪClԪ�أ�
��2��XZΪHCl��HClΪ���ۻ���������ʽΪ![]() ��X2YΪH2O��ˮ������ֻ���й��ۼ������ڹ��ۻ����
��X2YΪH2O��ˮ������ֻ���й��ۼ������ڹ��ۻ����
��3��XZΪHCl������ǿ����ʣ�����뷽��ʽΪ��HCl=H++Cl����HCl��Ca(ClO)2��Ӧ���ɴ�������Ȼ��ƣ��÷�Ӧ�Ļ�ѧ����ʽΪ��Ca(ClO)2+2HCl=2HClO+CaCl2��

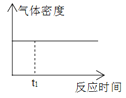
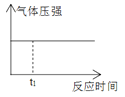
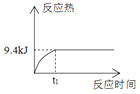
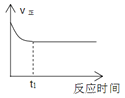
����Ŀ��1mol H2��1mol I2���ں��º����ܱ������з�����Ӧ��H2(g)+I2(g)![]() 2HI(g)+9.4kJ����t1ʱ�̵���ƽ��״̬�������������뷴Ӧʱ��Ĺ�ϵ��������ʵ���ǣ� ��
2HI(g)+9.4kJ����t1ʱ�̵���ƽ��״̬�������������뷴Ӧʱ��Ĺ�ϵ��������ʵ���ǣ� ��
|
|
|
|
A | B | C | D |
A. AB. BC. CD. D
����Ŀ����֪��A��g���� 2B��g��![]() C��g��+2D��s�������ⶨ���ڲ�ͬ�¶��¸÷�Ӧ��ƽ�ⳣ�����£�
C��g��+2D��s�������ⶨ���ڲ�ͬ�¶��¸÷�Ӧ��ƽ�ⳣ�����£�
�¶ȣ��棩 | 250 | 300 | 350 |
K | 30 | 15.78 | 12.5 |
��1���÷�ӦΪ__________��Ӧ(����ȡ������ȡ�)��ƽ�ⳣ��K�ı���ʽΪK=____________
��2������÷�Ӧ�ں��ݾ��ȵ��ܱ������н��У��������жϸ÷�Ӧ�Ѵﻯѧƽ��״̬����________��
��������ѹǿ���� �� ���������c(A)���� �ۦ���(B)������(A) �� �������¶Ȳ���
�������л��������ܶȲ��� �� c(A):c(b):c(c)=1:2:1
A.�������� B.�ڢܢ� C.�٢ڢܢ� D. �٢ڢܢݢ�
��3�������B��ת���ʲ��ӿ컯ѧ��Ӧ���ʣ����д�ʩ���е���_____________��������ĸ��
a���ں�ѹ�����ٳ���He b���ں������ٳ���A
c���ı䷴Ӧ�Ĵ��� d�������¶�
��4����ij�¶��£��÷�Ӧ�ﵽƽ��ʱ��÷�Ӧ�����������Ũ��Ϊc(A)=0.4mol��L��1��c(B)=0.4 mol��L��1��c(C)=0.8 mol��L��1, ���ʱ���¶�Ϊ___________��
��5��ij�¶��£�������̶���1L���ܱ������н�2 mol A��2 mol B��ϣ���ò�ͬʱ�̵�ѹǿ��ϵ���£�
ʱ��t/h | 0 | 1 | 2 | 4 | 8 | 16 |
��ѹǿp/MPa | 20 | 18 | 16.5 | 15 | 12.5 | 12.5 |
�ټ��㷴Ӧ��2hʱ��(A)=________________
�ڼ���ƽ��ʱB��ת����Ϊ __________�����¶��·�Ӧ��ƽ�ⳣ��ֵ________��
������ѹǿp����ʼѹǿp0��ʾ��Ӧ��ϵ�������ʵ���n(��)��������C�����ʵ���n��C��,�� n(�� )=___________mol��n��C����___________mol,��Ӧ��A��ת���ʦ���A���ı���ʽΪ_______________________��