题目内容
【题目】一块表面已部分被氧化为氧化钠的金属钠样品5.4g,将其投入94.7g 水中,放出1120mL H2(标准状况下)。
(1)请写出该样品放入水中时发生的反应的化学方程式:_______。滴加酚酞后溶液颜色_______,由此可知溶液呈_______ (“酸性”“碱性” 、 或“中性”)。
(2)样品中含金属钠_______g。
(3)所得的溶液的质量分数为_______。
【答案】 2Na+2H2O=2NaOH+H2↑ Na2O+H2O= 2NaOH 变红 碱性 2.3g 8%
【解析】试题分析:本题考查钠、氧化钠与水的反应,有关混合物和溶质质量分数的计算。
(1)金属钠已部分被氧化为氧化钠,所以样品放入水中发生反应的化学方程式为2Na+2H2O=2NaOH+H2↑、Na2O+H2O=2NaOH。反应后生成的溶液为NaOH溶液,溶液呈碱性,滴加酚酞后溶液变红色。
(2)n(H2)=1.12L![]() 22.4L/mol=0.05mol,根据方程式2Na+2H2O=2NaOH+H2↑,n(Na)=0.1mol,样品中m(Na)=0.1mol
22.4L/mol=0.05mol,根据方程式2Na+2H2O=2NaOH+H2↑,n(Na)=0.1mol,样品中m(Na)=0.1mol![]() 23g/mol=2.3g。
23g/mol=2.3g。
(3)由钠生成的NaOH物质的量为0.1mol;样品中氧化钠的质量m(Na2O)=5.4g-2.3g=3.1g,n(Na2O)=3.1g![]() 62g/mol=0.05mol,根据方程式Na2O+H2O=2NaOH,由氧化钠生成的NaOH物质的量为0.1mol;反应后共生成NaOH物质的量为0.1mol+0.1mol=0.2mol,共生成NaOH的质量为0.2mol
62g/mol=0.05mol,根据方程式Na2O+H2O=2NaOH,由氧化钠生成的NaOH物质的量为0.1mol;反应后共生成NaOH物质的量为0.1mol+0.1mol=0.2mol,共生成NaOH的质量为0.2mol![]() 40g/mol=8g,根据质量守恒定律,反应后溶液的总质量为m(样品)+m(H2O)-m(H2)=5.4g+94.7g-0.05mol
40g/mol=8g,根据质量守恒定律,反应后溶液的总质量为m(样品)+m(H2O)-m(H2)=5.4g+94.7g-0.05mol![]() 2g/mol=100g,则所得溶液中NaOH的质量分数为8g
2g/mol=100g,则所得溶液中NaOH的质量分数为8g![]() 100g
100g![]() 100%=8%。
100%=8%。

 黄冈创优卷系列答案
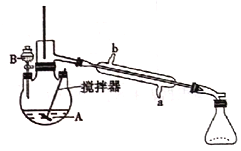
黄冈创优卷系列答案【题目】环已酮是工业上的一种重要有机合成原料和溶剂.实验室制备原理为: ,其反应的装置示意图如下(夹持装置加热装置略去):
,其反应的装置示意图如下(夹持装置加热装置略去):
已知:
物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 161.1(97.8) | 0.962 | 能溶于水 |
环已酮 | 155.6(95) | 0.948 | 微溶于水 |
(注:括号中的数据表示该有机物与水形成的具有固定组成的恒沸物的沸点)
(1)制备产品。通过仪器B____(填仪器名称)将酸性Na2Cr2O7和H2SO4混合溶被加到盛有环已醇的三颈烧瓶A中,通过______(填序号)方法加热到55-60℃进行反应。
a.酒精灯加热 b.油浴加热 c.水浴加热
(2)分离粗品。反应完成后,加入适量水,蒸馏,收集95-100℃的馏分(主要含环已酮粗品和水的混合物),试解释无法分离环己酮和水的原因是____________。
(3)提纯环已酮。
①在收集到的粗品中加NaCl固体至饱和,静置,分液。加入NaCl固体的作用是________。
②加入无水MgSO4固体,除去有机物中________ (填物质名称)。
③过滤,蒸馏,收集151-156℃馏分,得到精品。
(4)下列关于实验的叙述中,错误的是________。
A.冷凝管的冷水应该从b进从a出
B.实验开始时,温度计水银球应插入反应液中,便于控制反应液的温度
C.装置B中也可加入Na2Cr2O7和稀盐酸混合溶液
D.反应过程中,需不断搅拌
(5)利用环已酮做萃取剂可分离含Co2+、Mn2+的溶液,根据下图信息可判断,将pH范围控制在_______左右时可分离出Mn2+。