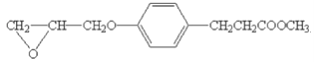
题目内容
【题目】化学与生活密切相关,下列有关说法错误的是
A. “地沟油”可以转化为生物柴油,提高资源的利用率
B. 丝绸和棉花的组成元素不完全相同
C. 木糖醇虽然有甜味,但不属于糖类
D. 向牛奶中加入果汁会出现沉淀,这是因为发生了中和反应
【答案】D
【解析】A. “地沟油”属于油脂,可以转化为生物柴油,提高资源的利用率,A正确;B. 丝绸的主要成分是蛋白质,棉花的主要成分是纤维素,二者组成元素不完全相同,B正确;C. 糖类是多羟基醛、多羟基酮和它们脱水缩合物,木糖醇含有5个羟基,虽然有甜味,但不属于糖类,C正确;D. 因牛奶中含有蛋白质,加入果汁能使蛋白质凝聚而沉淀,且牛奶不是酸,则不是酸碱之间的反应,D错误,答案选D。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】氮的化合物既是一种资源,也会给环境造成危害。
I.氨气是一种重要的化工原料。
(1)NH3与CO2在120°C,催化剂作用下反应生成尿素:CO2(g)+2NH3(g)![]() (NH2)2CO(s)+H2O(g),ΔH= -x KJ/mol (x>0),其他相关数据如表:
(NH2)2CO(s)+H2O(g),ΔH= -x KJ/mol (x>0),其他相关数据如表:
物质 | NH3(g) | CO2(g) | CO(NH2)2(s) | H2O(g) |
1mol分子中的化学键断裂时需要吸收的能量/KJ | a | b | z | d |
则表中z(用x a b d表示)的大小为________。
(2)120℃时,在2L密闭反应容器中充入3mol CO2与NH3的混合气体,混合气体中NH3的体积分数随反应时间变化关系如图所示,该反应到达平衡时CO2的平均反应速率为_____, 此温度时的平衡常数为_____。
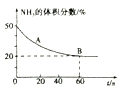
下列能使正反应的化学反应速率加快的措施有___________.
① 及时分离出尿素 ② 升高温度 ③ 向密闭定容容器中再充入CO2 ④ 降低温度
Ⅱ.氮的氧化物会污染环境。目前,硝酸厂尾气治理可采用NH3与于NO在催化剂存在的条件下作用,将污染物转化为无污染的物质。某研究小组拟验证NO能被氨气还原并计算其转化率(已知浓硫酸在常温下不氧化NO气体)。
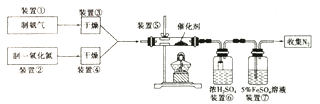
(l)写出装置⑤中反应的化学方程式_________。
(2)装置①和装置②如下图,仪器A的名称为_____,其中盛放的药品名称为_______。

装置②中,先在试管中加入2-3 粒石灰石,注入适量稀硝酸,反应一段时间后,再塞上带有细铜丝的胶塞进行后续反应,加入石灰石的作用是________。
(3)装置⑥中,小段玻璃管的作用是______;装置⑦的作用是除去NO, NO与FeSO4溶液反应形成棕色[Fe(NO)]SO4溶液,同时装置⑦还用来检验氨气是否除尽,若氨气未除尽,可观察到的实验现象是_________。
【题目】近年来,天津连续出现了严重的雾霾天气,给人们的出行及身体造成了极大的危害。研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)利用钠碱循环法可脱除烟气中的SO2。
①在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是___。
②吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
由上表判断,NaHSO3溶液显______性(填“酸”、“碱”或“中”),用化学平衡原理解释:__________。
③当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
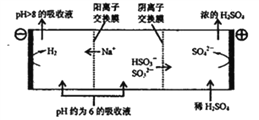
写出HSO3-在阳极放电的电极反应式:____________,当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。
(2)用CH4催化还原NO2可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) =4NO(g) + CO2(g) + 2H2O(g); ΔH=-574 kJ mol-1
CH4(g) + 4NO(g) =2N2(g) + CO2(g) + 2H2O(g):ΔH=-1160 kJ mol-1
若用标准状况下4.48 L CH4还原 NO2至N2,整个过程中转移的电子总数为______(阿伏加德罗常数的值用NA表示),放出的热量为_________kJ。
(3)工业上合成氨所需氢气的制备过程中,其中的一步反应为:
CO(g) + H2O(g) ![]() CO2(g) + H2(g): ΔH<0
CO2(g) + H2(g): ΔH<0
—定条件下,将CO(g)与H2O(g)以体枳比为1:2置于密闭容器中发生上述反应,达到平衡时测得CO(g)与H2O(g)体积比为丨:6,则平衡常数K=__________(计算结果保留两位小数)。