题目内容
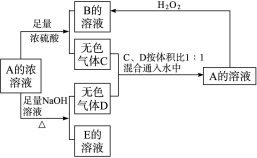
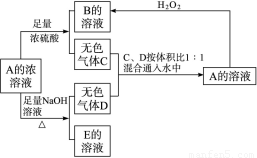
(12分)从某物质A的水溶液出发有如图所示的转化关系:
回答下列问题:
(1)写出C、D、E的化学式:C________,D________,E________。
(2)检验B溶液中阴离子的实验操作和实验现象是
________________________________________________________________________。
(3)写出下列反应的离子方程式:
①A+足量NaOH溶液
________________________________________________________________________。
②C、D按体积比1∶1通入水中
________________________________________________________________________。
③A+H2O2―→________________________________________。
(1)SO2 NH3 Na2SO3
(2)取少量B溶液于试管中,加入BaCl2溶液产生白色沉淀,再加少量稀HNO3,白色沉淀不溶解,证明含有SO
(3)①NH+HSO+2OH-SO+NH3↑+2H2O
②NH3+SO2+H2O===NH+HSO
③HSO+H2O2===H++SO+H2O?
【解析】A与NaOH溶液加热生成气体D,说明A为铵盐,A与浓硫酸生成气体C,说明A为挥发性盐,B为硫酸盐,A与H2O2反应生成B,说明A中含SO或HSO,由C、D按体积比1∶1通入水中得A,推断A中含HSO。由此推断得A为NH4HSO3。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案(12分)在温度T ℃下,某Ba(OH)2稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向该溶液中逐滴加入pH=b的盐酸,测得混合溶液的部分pH如下表所示:
|
序号 |
氢氧化钡的体积/mL |
盐酸的体积/mL |
溶液的pH |
|
① |
22.00 |
0.00 |
8 |
|
② |
22.00 |
18.00 |
7 |
|
③ |
22.00 |
22.00 |
6 |
(1)依据题意判断,T ℃________25 ℃(填“大于”、“小于”或“等于”),该温度下水的离子积KW=________。
(2)b=________,原Ba(OH)2稀溶液的物质的量浓度为________。
(3)该温度下,向1 L硫酸与硫酸钠的混合溶液中加入3 L该Ba(OH)2的稀溶液时,沉淀正好达最大值,从所得溶液中取出4 mL并加水稀释至20 mL,测得溶液的pH为7,则原硫酸与硫酸钠混合溶液的pH为________,其中Na2SO4的物质的量浓度为________。