题目内容
【题目】已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO和KClO3,且![]() 的值与温度高低有关.当n(KOH)=amol时,下列有关说法错误的是( )
的值与温度高低有关.当n(KOH)=amol时,下列有关说法错误的是( )
A. 若某温度下,反应后 =2,则溶液中
=2,则溶液中 =0.2
=0.2
B. 参加反应的氯气的物质的量等于0.5a mol
C. 改变温度,反应中转移电子的物质的量ne的范围: ![]() a mol≤ ne ≤
a mol≤ ne ≤![]() a mol
a mol
D. 改变温度,产物中KClO3的最大理论产量为![]() mol
mol
【答案】A
【解析】A.令n(ClO-)=1mol,反应后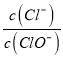 =2,则n(Cl-)=2mol,根据电子转移守恒,5×n(ClO3-)+1×n(ClO-)=1×n(Cl-),即5×n(ClO3-)+1×1mol=1×2mol,解得n(ClO3-)=0.2mol,则溶液中
=2,则n(Cl-)=2mol,根据电子转移守恒,5×n(ClO3-)+1×n(ClO-)=1×n(Cl-),即5×n(ClO3-)+1×1mol=1×2mol,解得n(ClO3-)=0.2mol,则溶液中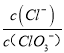 =
=![]() =10,故A错误;B.由Cl原子守恒可知,2n(Cl2)=n(KCl)+n(KClO)+n(KClO3),由钾离子守恒可知n(KCl)+n(KClO)+n(KClO3)=n(KOH),故参加反应的氯气的物质的量=
=10,故A错误;B.由Cl原子守恒可知,2n(Cl2)=n(KCl)+n(KClO)+n(KClO3),由钾离子守恒可知n(KCl)+n(KClO)+n(KClO3)=n(KOH),故参加反应的氯气的物质的量=![]() n(KOH)=0.5amol,故B正确;C.氧化产物只有KClO3时,转移电子最多,根据电子转移守恒n(KCl)=5(KClO3),由钾离子守恒:n(KCl)+n(KClO3)=n(KOH),故n(KClO3)=
n(KOH)=0.5amol,故B正确;C.氧化产物只有KClO3时,转移电子最多,根据电子转移守恒n(KCl)=5(KClO3),由钾离子守恒:n(KCl)+n(KClO3)=n(KOH),故n(KClO3)= ![]() n(KOH)=
n(KOH)= ![]() a mol,转移电子最大物质的量为:
a mol,转移电子最大物质的量为: ![]() a mol×5=
a mol×5=![]() a mol,氧化产物只有KClO时,转移电子最少,根据电子转移守恒n(KCl)=n(KClO),根据钾离子守恒:n(KCl)+n(KClO)=n(KOH),故:n(KClO)=
a mol,氧化产物只有KClO时,转移电子最少,根据电子转移守恒n(KCl)=n(KClO),根据钾离子守恒:n(KCl)+n(KClO)=n(KOH),故:n(KClO)= ![]() n(KOH)=
n(KOH)= ![]() a mol,转移电子最小物质的量=
a mol,转移电子最小物质的量=![]() a mol×1=
a mol×1=![]() a mol,则反应中转移电子的物质的量ne的范围为:
a mol,则反应中转移电子的物质的量ne的范围为: ![]() a mol≤ne≤
a mol≤ne≤![]() a mol,故C正确;D.氧化产物只有KClO3时,其物质的量最大,根据电子转移守恒n(KCl)=5(KClO3),由钾离子守恒:n(KCl)+n(KClO3)=n(KOH),故n最大(KClO3)=
a mol,故C正确;D.氧化产物只有KClO3时,其物质的量最大,根据电子转移守恒n(KCl)=5(KClO3),由钾离子守恒:n(KCl)+n(KClO3)=n(KOH),故n最大(KClO3)= ![]() n(KOH)=
n(KOH)= ![]() a mol,故D正确;故选A。
a mol,故D正确;故选A。

 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
