题目内容
由CO、CH4和C2H2组成的混合气体4.48L(标况),在足量氧气中充分燃烧后,生成的气体先通过足量的浓H2SO4再通过足量的NaOH溶液,NaOH溶液增重13.2g,则混合气体中含C2H2的物质的量n为( )
| A.n<0.1mol | B.n=0.1mol |
| C.0.1mol<n<0.15mol | D.无法确定 |
B
试题分析:一氧化碳、甲烷和乙炔组成的混合气体4.48L(标准状况),混合气体的物质的量为4.48L/22.4(L/mol) =0.2mol.
NaOH溶液吸收二氧化碳,故NaOH溶液增重13.2克为二氧化碳质量,所以二氧化碳的物质的量为13.2g/44(g/mol) =0.3mol.
所以平均组成中平均碳原子数为0.3mol/0.2mol=3/2,
一氧化碳、甲烷分子中都含有一个碳原子,可以看做1个组分,
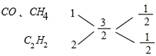
所以一氧化碳、甲烷的总物质的量与乙炔的物质的量之比为1/2:1/2=1:1。
所以混合物中乙炔的物质的量为0.2mol×(1/2)=0.1mol。
故选B。
点评:考查烃混合物分子式确定,难度较大,注意利用平均分子组成判断烃的组成,常用方法有1、平均碳法 2、平均氢法 3、平均碳氢分子式法 4、平均式量法。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

