题目内容
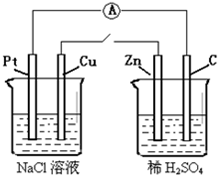 如图所示,将两烧杯用导线如图连接,Pt、Cu、Zn、C分别为四电极,当闭合开关后,以下表示正确的是( )
如图所示,将两烧杯用导线如图连接,Pt、Cu、Zn、C分别为四电极,当闭合开关后,以下表示正确的是( )分析:当闭合开关后,右边装置中锌和稀硫酸能自发的进行氧化还原反应,且锌和碳棒是活泼性不同导体,所以右边装置构成了原电池;左边装置虽然铂和铜的活泼性不同但不能自发的进行氧化还原反应,当闭合开关后,右边装置是原电池,所以左边装置有外加电源就形成了电解池.根据原电池原理分析右边装置,根据电解池原理分析左边装置即可.
解答:解:A、右边装置是原电池,锌作负极,左边装置是电解池,铜连接负极,所以铜是电解池中的阴极,故A错误;
B、左边装置中,铜是阴极,阴极上水得电子生成氢气和氢氧根离子,所以铜极附近显碱性,故B正确;
C、碳棒是原电池正极,氢离子的碳棒上得电子发生还原反应,故C错误;
D、电子流向为:原电池负极→电解池阴极→电解池阳极→原电池正极,即锌极→铜极→铂极→碳极,故D错误;
故选B.
B、左边装置中,铜是阴极,阴极上水得电子生成氢气和氢氧根离子,所以铜极附近显碱性,故B正确;
C、碳棒是原电池正极,氢离子的碳棒上得电子发生还原反应,故C错误;
D、电子流向为:原电池负极→电解池阴极→电解池阳极→原电池正极,即锌极→铜极→铂极→碳极,故D错误;
故选B.
点评:本题考查了原电池和电解池原理,难度不大,会根据装置特点判断原电池和电解池.

练习册系列答案
相关题目
如图所示,将两烧杯用导线如图相连,Pt、Mg、A1、C分别为四个电极,当闭合开关S后,以下表述正确的是
| A.电流计指针不发生偏转 |
| B.Al、Pt两电极有氢气生成 |
| C.甲池pH减小,乙池pH不变 |
| D.Mg、C两电极生成的气体在一定条件下可恰好完全反应 |
 如图所示,将两烧杯用导线如图相连,Pt、Cu、Zn、C分别为四个电极,当闭合开关后,则以下叙述正确的是( )
如图所示,将两烧杯用导线如图相连,Pt、Cu、Zn、C分别为四个电极,当闭合开关后,则以下叙述正确的是( )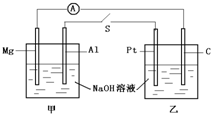 如图所示,将两烧杯用导线如图相连,Pt、Mg、A1、C分别为四个电极,当闭合开关S后,以下表述正确的是( )
如图所示,将两烧杯用导线如图相连,Pt、Mg、A1、C分别为四个电极,当闭合开关S后,以下表述正确的是( )