题目内容
【题目】一种以黄铜矿和硫磺为原料制取钢和其他产物的新工艺,原料的综合利用率较高。其主要流程如下:
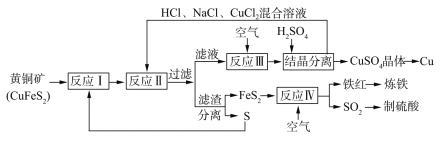
已知:“反应Ⅱ”的离子方程式为Cu2++CuS+4Cl-=2[CuCl2]-+S
回答下列问题:
(1)铁红的化学式为________;
(2)“反应Ⅱ”的还原剂是________(填化学式);
(3)除CuS外“反应II”的产物还有_________(填化学式);
(4)“反应Ⅲ”的离子方程式为_________;
(5)某同学设想利用电化学原理实现以CuSO4、SO2为原料制备Cu和H2SO4,并吸收炼铁过程中产生的CO尾气,实现资源与能源的综合利用。该同学据此组装出的装置如下图所示:

闭合该装置中的K,A池中通入SO2的Pt电极的电极反应式为__________,B池中生成的气体X的电子式为________,若在C池中生成64gCu,则整个装置中共生成H2SO4_____mol。
【答案】 Fe2O3 CuS FeS2 4[CuCl2]-+O2+4H+=4Cu2++8Cl-+2H2O SO2+2H2O-2e-=SO42-+4H+ ![]() 2
2
【解析】(1)铁红的化学式为Fe2O3;(2)“反应Ⅱ”的离子方程式为Cu2++CuS+4Cl-=2[CuCl2]-+S,CuS中硫的化合价升高,“反应Ⅱ”的还原剂是CuS;(3)由流程可知,黄铁矿分解生成的Fe、Cu均为+2价,则反应I的产物为FeS2、CuS;(4)反应Ⅲ中生成铜离子,则离子反应为4CuCl2-+O2+4H+═4Cu2++8Cl-+2H2O;(5)A池是原电池,SO2为负极,A池中通入SO2的Pt电极的电极反应式为SO2+2H2O-2e-=SO42-+4H+ ; B池原电池,CO为负极,氧化产物为CO2,B池中生成的气体X的电子式为![]() ;C中发生2CuSO4+2H2O
;C中发生2CuSO4+2H2O![]() 2Cu+O2+2H2SO4,64gCu反应,生成1molH2SO4,A中原电池也失去2mol电子,生成1molH2SO4,若在C池中生成64gCu,则整个装置中共生成H2SO42mol。
2Cu+O2+2H2SO4,64gCu反应,生成1molH2SO4,A中原电池也失去2mol电子,生成1molH2SO4,若在C池中生成64gCu,则整个装置中共生成H2SO42mol。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案【题目】在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g) + Y(g)![]() M(g) +N(g),所得实验数据如下表所示:
M(g) +N(g),所得实验数据如下表所示:
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.40 | 0.10 | 0.090 |
② | 800 | 0.10 | 0.40 | 0.080 |
③ | 800 | 0.20 | 0.30 | a |
④ | 900 | 0.10 | 0.15 | b |
下列说法正确的是
A. 实验①中,若5 min时测得n(M)=0.050 mol,则05 min内,用N表示的平均反应速率v(N) =1.0×10-2 mol/(L min)
B. 实验②中,该反应的平衡常数K=2.0
C. 实验③中,反应达到平衡时,X的转化率为40%
D. 实验④中,反应达到平衡时,b<0.060


