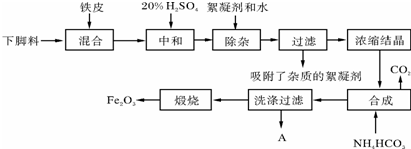
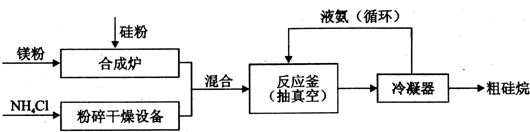
题目内容
6.下列各组物质发生的变化中,均属于化学变化的一组是( )| A. | 少量酒精在空气中挥发不见了;少量酒精在空气中燃烧后消失 | |
| B. | 块状生石灰在空气中逐渐变成粉末;晶体碳酸钠在空气中逐渐变成粉末 | |
| C. | 木炭燃烧发光、发热;电灯发光、发热 | |
| D. | 石灰水中通入少量CO2后变浑浊;室温下的饱和石灰水加热后变浑浊 |
分析 判断一个变化是物理变化还是化学变化,要依据在变化过程中有没有生成其他物质,生成其他物质的是化学变化,没有生成其他物质的是物理变化.
解答 解:A.少量酒精在空气中燃烧能生成水和二氧化碳,属于化学变化,少量酒精在空气中挥发的过程中属于酒精从液态变为气态,没有新物质生成,属于物理变化,故A错误;
B.块状生石灰在空气中逐渐变为白色粉末的过程中能生成氢氧化钙,属于化学变化,晶体碳酸钠在空气中逐渐变成粉末为十水合碳酸钠分解生成粉状碳酸钠和水,属于化学变化,故B正确;
C.木炭在空气中燃烧能生成二氧化碳,属于化学变化;灯泡通电,发光、放热的过程中没有新物质生成,属于物理变化.故C错误;
D.澄清石灰水中通入适量二氧化碳能生成碳酸钙和水,属于化学变化;氢氧化钙溶解度随着温度的升高而降低,澄清的饱和石灰水加热升温后变浑浊是溶解度降低析出溶质,该过程中没有新物质生成,属于物理变化,故D错误;
故选B.
点评 本题考查化学变化和物理变化的区别,解答本题要分析变化过程中是否有新物质生成,如果没有新物质生成就属于物理变化,如果有新物质生成就属于化学变化,题目较简单.一般地,物理变化有物质的固、液、气三态变化和物质形状的变化.

练习册系列答案
相关题目
16.下列物质属于同分异构体的是( )
| A. | 葡萄糖与蔗糖 | B. | 蔗糖与麦芽糖 | C. | 动物油和脂肪 | D. | 淀粉和纤维素 |
17.酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是有碳粉,二氧化锰,氯化锌和氯化铵等组成的填充物,该电池在放电过程产生MnOOH,回收处理该废电池可以得到多种化工原料,有关数据表所示:
溶解度/(g/100g水)
回答下列问题:
(1)该电池的负极为锌,正极反应式为MnO2+H++e-=MnOOH;
(2)维持电流强度为0.5A,电池工作5分钟,理论消耗Zn0.05gg;(已知F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有氯化锌和氯化铵,两者可以通过加热浓缩、冷却结晶分离回收,滤渣的主要成分是二氧化锰、碳粉和MnOOH,欲从中得到较纯的二氧化锰,最简便的方法是空气中加热,其原理是碳粉转变为二氧化碳,MnOOH氧化为二氧化锰;
(4)用废电池的锌皮制作七水合硫酸锌,需去除少量杂质铁,其方法是:加入稀硫酸和双氧水,溶解,铁变为Fe3+加碱调节PH为2.7,铁刚好完全沉淀(离子浓度≤1×10-5 mo1•L-1时即可认为离子沉淀完全)继续加碱调节PH为6锌开始沉淀(假定此时溶液中Zn2+的浓度为0.1mo1•L-1).若上述过程不加双氧水的后果Zn2+和Fe2+分离不开,原因是Fe(OH)2和Zn(OH)2的Ksp相近.
溶解度/(g/100g水)
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
(1)该电池的负极为锌,正极反应式为MnO2+H++e-=MnOOH;
(2)维持电流强度为0.5A,电池工作5分钟,理论消耗Zn0.05gg;(已知F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有氯化锌和氯化铵,两者可以通过加热浓缩、冷却结晶分离回收,滤渣的主要成分是二氧化锰、碳粉和MnOOH,欲从中得到较纯的二氧化锰,最简便的方法是空气中加热,其原理是碳粉转变为二氧化碳,MnOOH氧化为二氧化锰;
(4)用废电池的锌皮制作七水合硫酸锌,需去除少量杂质铁,其方法是:加入稀硫酸和双氧水,溶解,铁变为Fe3+加碱调节PH为2.7,铁刚好完全沉淀(离子浓度≤1×10-5 mo1•L-1时即可认为离子沉淀完全)继续加碱调节PH为6锌开始沉淀(假定此时溶液中Zn2+的浓度为0.1mo1•L-1).若上述过程不加双氧水的后果Zn2+和Fe2+分离不开,原因是Fe(OH)2和Zn(OH)2的Ksp相近.
14.设NA 为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 1mol羟基中电子数为10NA | |
| B. | 常温下,1L 0.1mol/L的NH4NO3的溶液中氮原子数为0.2NA | |
| C. | 在反应KIO3+6HI=KI+3 I2+3 H2O中,每生成3mol I2转移的电子数为6NA | |
| D. | 常温常压下,22.4L乙烯中C-H键数为4NA |
1.下列说法不正确的是( )
| A. | 因SiO2不溶于水,故SiO2不是酸性氧化物 | |
| B. | 在反应SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑中SiO2作氧化剂 | |
| C. | SiO2是一种空间立体网状结构的晶体,熔点高、硬度大 | |
| D. | 氢氟酸能够刻蚀玻璃,故不能用玻璃瓶来盛装氢氟酸 |
6.下列化学方程式或离子方程式中正确的是( )
| A. | 金属钠加入无水乙醇中:Na+C2H5OH→C2H5ONa+H2↑ | |
| B. | 过量的乙酸跟Na2CO3溶液反应:2H++CO32-═H2O+CO2↑ | |
| C. | 溴乙烷在NaOH水溶液中加热:CH3CH2Br+NaOH→CH2═CH2↑+NaBr+H2O | |
| D. | 苯酚钠溶液中通入CO2: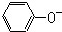 +CO2+H2O→ +CO2+H2O→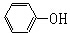 +HCO${\;}_{3}^{-}$ +HCO${\;}_{3}^{-}$ |
7.下列几种微粒中能影响水的电离平衡,且能使水的电离平衡逆向移动的是( )
| A. | HSO4- | B. | Cl- | C. | 13X3+ | D. | 16X2- |