题目内容
在100 mL 0.10 mol/L的AgNO3溶液中加入100 mL溶有2.08 g BaCl2的溶液,再加入100 mL溶有0.01 mol CuSO4·5H2O的溶液,充分反应,则下列说法中正确的是( )
A.最终得到白色沉淀和无色溶液
B.最终得到的白色沉淀是等物质的量的两种化合物的混合物
C.在最终得到的溶液中,Cl-的物质的量为0.02 mol
D.最终得到的溶液相当于一种纯净物的溶液
【答案】
B
【解析】
试题分析:由题可知AgNO3的物质的量为0.01mol,BaCl2的物质的量为0.01mol,CuSO4·5H2O的物质的量为0.01 mol,充分反应后,得到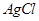 和
和 的白色沉淀,其物质的量分别都是0.01mol,溶液中含有的离子有
的白色沉淀,其物质的量分别都是0.01mol,溶液中含有的离子有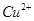 、
、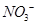 、
、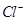
A.最终得溶液中含有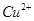 ,溶液显蓝色,A项错误;
,溶液显蓝色,A项错误;
B.最终得到的白色沉淀是等物质的量的两种化合物的混合物,正确;
C.在最终得到的溶液中,Cl-的物质的量应该为0.01mol,C项错误;
D.最终得到的溶液相当于混合物的溶液,D项错误。
考点:离子反应
点评:本题考查离子反应,对溶液中物质的定量计算,本题解答的关键在先求出反应的各物质的物质的量,再根据方程式即可求得所要结果。

练习册系列答案
相关题目
重水(D2O)的离子积为1.6×10-15,可以用pH一样的定义来规定pD=-lgc(D+),以下关于pD的叙述正确的是( )
| A、中性溶液的pD=7.0 | B、含0.01 mol的NaOD的D2O溶液1 L,其pD=12.0 | C、溶解0.01 mol DCl的D2O溶液1 L,其pD=2.0 | D、在100 mL 0.25 mol?L-1的DCl重水溶液中,加入50 mL 0.2 mol?L-1的NaOD的重水溶液,其pD=1.0 |