题目内容
某温度下,重水D2O的离子积为1.6×10-15,若用pH一样的定义来规定pD=-lgc(D+),以下关于pD的叙述正确的是( )
A.中性溶液的pD=7.0
B.含0.01 mol的NaOH的D2O溶液1 L,其pD=12.0
C.溶有0.01 mol DCl的水溶液1 L,其pD=2.0
D.在100 mL 0.25 mol·L-1的DCl重水溶液中,加入50 mL 0.2 mol·L-1的NaOD的重水溶液,其pD=1.0
【答案】
CD
【解析】
试题分析:KW=16×10-16,则c(D+)=4×10-8 mol·L-1
A.pD=-lg4×10-8=8-2lg2=7.4,A错。
B中c(OD-)=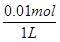 ="0.01" mol·L-1,pD=
="0.01" mol·L-1,pD=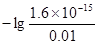 =-lg16×10-14=12.8,B错。
=-lg16×10-14=12.8,B错。
C.c(D+)=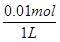 ="0.01" mol·L-1
="0.01" mol·L-1
pD=-lg0.01=2.0(符合题意)
D.c(D+)=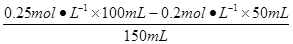 ="0.1" mol·L-1
="0.1" mol·L-1
pD=-lg0.1=1.0
所以答案选CD。
考点:考查水的离子积常数和溶液中离子浓度大小的计算
点评:该题是中等难度试题的考查,也是高考中的常见题型,试题综合性强,注重解题的灵活性和能力的培养,有助于培养学生的逻辑推理能力和灵活应变能力,也有利于培养学生的知识迁移能力。

练习册系列答案
相关题目

 比为_________。
比为_________。 D2O)的离子积常数为1×10-12。若用pH一样的定义来规定pD值,则pD=-lg{ c(D+)}。该温度下:纯重水的pD=_____,1L溶有0.01molNaOD的D2O溶液,其pD="___" ,1 00mL0.1mol/L的D2SO4溶液与100mL0.4mol/L的KOD的D2O溶液混合,pD=______。
D2O)的离子积常数为1×10-12。若用pH一样的定义来规定pD值,则pD=-lg{ c(D+)}。该温度下:纯重水的pD=_____,1L溶有0.01molNaOD的D2O溶液,其pD="___" ,1 00mL0.1mol/L的D2SO4溶液与100mL0.4mol/L的KOD的D2O溶液混合,pD=______。