题目内容
(9分) 向一体积不变的密闭容器中加入2 mol A、0.6 mol C和一定量的B三种气体。
一定条件下发生反应,各物质浓度随时间变化如图1所示。图2为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。
已知t3-t4阶段为使用催化剂;图1中t0-t1阶段c(B)未画出。

(1)若t1=15 min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)=________。
(2)t4-t5阶段改变的条件为________,B的起始物质的量为________。各阶段平衡时对应的平衡常数如下表所示:
|
t1~t2 |
t2~t3 |
t3~t4 |
t4~t5 |
t5~t6 |
|
K1 |
K2 |
K3 |
K4 |
K5 |
则K1=________(保留两位小数),K1、K2、K3、K4、K5之间的关系为________(用“>”“<”或“=”连接)。
(3)t5-t6阶段保持容器内温度不变,若A的物质的量共变化了0.01 mol,而此过程中容器与外界的热交换总量为a kJ,写出此温度下该反应的热化学方程式:________________________。
(4)在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,达到平衡时体系中各物质的量与t1时刻相等,a、b、c要满足的条件为________。
(1)0.02 mol·L-1·min-1 (2)减小压强 1.0 mol 0.84 K1=K2=K3=K4<K5
(3)2A(g)+B(g) 3C(g) ΔH=+200a kJ·mol-1 (4)a+2c/3=2.4且b+c/3=1.2
3C(g) ΔH=+200a kJ·mol-1 (4)a+2c/3=2.4且b+c/3=1.2
【解析】
试题分析:(1)v(C)=
(2)根据图示可知t4-t5平衡不移动,但是速率降低,所以改变的条件为减小压强。因此该反应的方程式为2A(g)+B(g)=3C(g),反应前后气体的物质的量不变,因此B起始的物质的量为1mol。四个阶段都各改变一种不同的条件,根据图2可以判断t2~t3改变浓度,t3~t4使用催化剂,t4~t5改变压强,t5~t6改变温度,根据速率的变化,以及平衡移动的方向,可知该反应是吸热反应,平衡常数是温度的函数,所以K1=K2=K3=K4<K5。
(3)若起始时容器中加入a mol A、b mol B和c mol C,达到平衡时体系中各物质的量与t1时刻相等,所以将C转化为A和B,与起始时加入的物质的量相同即可。起始时将C转化为A和B,A为2.4mol,B为1.2mol则a+2c/3=2.4且b+c/3=1.2。
考点:影响化学平衡的条件
点评:本题综合性强,难度较大,要认真分析条件才可以准确作答,锻炼学生的思维能力。

 阅读快车系列答案
阅读快车系列答案(9分) 向一体积不变的密闭容器中加入2 mol A、0.6 mol C和一定量的B三种气体。
一定条件下发生反应,各物质浓度随时间变化如图1所示。图2为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。
已知t3-t4阶段为使用催化剂;图1中t0-t1阶段c(B)未画出。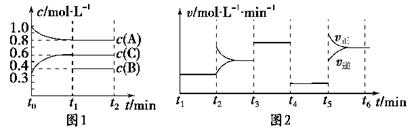
(1)若t1=15 min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)=________。
(2)t4-t5阶段改变的条件为________,B的起始物质的量为________。各阶段平衡时对应的平衡常数如下表所示:
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
(3)t5-t6阶段保持容器内温度不变,若A的物质的量共变化了0.01 mol,而此过程中容器与外界的热交换总量为a kJ,写出此温度下该反应的热化学方程式:________________________。
(4)在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,达到平衡时体系中各物质的量与t1时刻相等,a、b、c要满足的条件为________。
 2NH3(g);△H<0 。
2NH3(g);△H<0 。
 2NH3(g);△H<0 。
2NH3(g);△H<0 。