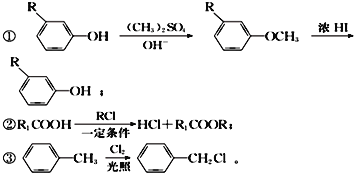
��Ŀ����
����Ŀ��ijͬѧ����������ȡ������������Ҫ�ɷ�ΪFe2O3��SiO2��Al2O3��������������������ȡ�̷���FeSO4��7H2O��,��Ƶ�������ͼ��ʾ��

��1������1����Ҫ�ɷ�Ϊ_________���ѧʽ����ͬ�����Լ�X���ѡ��_________��
��2�����д�ʩ�����������ȡ���ʵ���_________ ������ĸ����
A.���������� B.��ϡ���ỻΪ98% ��Ũ����
C.�ʵ��ӿ�������� D.�ʵ������¶�
��3������e��ʵ�����������Ũ����_______��________��ϴ�ӡ����
��4��ijС��ͬѧ������KMnO4��Һ�ζ��̷���Ʒ��ˮ��Һ,���ⶨ�̷���Ʒ����Ԫ�ص�����������
�ٸ�ʵ��ԭ�������ӷ���ʽ�ɱ�ʾΪ________________��
��ȡmg���̷���Ʒ����0.1mol/L ��KMnO4��Һ���еζ�,�ڴ�ʵ������й���ȥ100 mL KMnO4��Һ,����̷���Ʒ����Ԫ�ص���������Ϊ________��
���𰸡� SiO2 Fe ACD ��ȴ�ᾧ ���� 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O ![]()
���������������������������������ȡ����������ȡ�̷�Ϊ���壬�������̵ķ�������������Ի�ѧ��Ӧ���ʵ�Ӱ������ѧʵ��Ļ�������������������Ԫ�����������IJⶨ�������м���ϡ��������ķ�ӦΪ��Fe2O3+3H2SO4=Fe2��SO4��3+3H2O��Al2O3+3H2SO4=Al2��SO4��3+3H2O��SiO2�������������SiO2��ϡ�����Ӧ�������1����Ҫ�ɷ�ΪSiO2����Һ1�к���Fe2��SO4��3��Al2��SO4��3���Թ�����H2SO4������Һ1�м�������NaOH��Һ��Fe2��SO4��3ת��ΪFe��OH��3������Al2��SO4��3��H2SO4ת��ΪNaAlO2��Na2SO4�������2�ijɷ�ΪFe��OH��3��Fe��OH��3��ϡ�����ܽ�õ�����Һ3ΪFe2��SO4��3��Һ����Һ3�м����Լ�X�õ�FeSO4��Һ��Ϊ�˲����������ʣ��Լ�X�����Fe��
��1��������������������1����Ҫ�ɷ�ΪSiO2���Լ�X���ѡ��Fe��
��2��A�����������������Ӵ�����������������ȡ���ʣ�B�98%��Ũ������ˮ�����٣�H+��Ũ�Ⱥ�С���������������ȡ���ʣ�C��ʵ��ӿ�������ʣ������������ȡ���ʣ�D��ʵ������¶ȣ������������ȡ���ʣ���ѡACD��
��3������eΪ��FeSO4��Һ�л��FeSO4��7H2O��ʵ�����������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ����
��4��������KMnO4��Һ����ǿ�����ԣ�Fe2+���л�ԭ�ԣ�����Fe2+������KMnO4��Һ������Fe3+��KMnO4����ԭ��Mn2+����Ӧ�����ӷ���ʽΪ��5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O��
��n��KMnO4��=0.1mol/L![]() 0.1L=0.01mol����n��Fe2+��=5n��KMnO4��=0.05mol����Ԫ�ص�����m=0.05mol
0.1L=0.01mol����n��Fe2+��=5n��KMnO4��=0.05mol����Ԫ�ص�����m=0.05mol![]() 56g/mol=2.8g���̷���Ʒ����Ԫ�ص���������Ϊ
56g/mol=2.8g���̷���Ʒ����Ԫ�ص���������Ϊ![]() 100%��
100%��