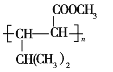题目内容
【题目】某实验小组采用刻蚀废液(主要含CuCl2、FeCl3、FeCl2、HCl)制取Cu和Cu2Cl2,实验流程如下:
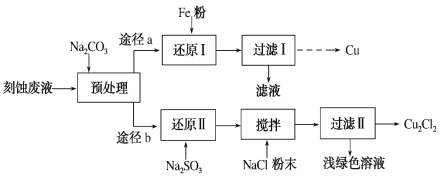
已知:Cu2Cl2是白色固体,微溶于水,难溶于乙醇,受潮后在空气中易被迅速氧化。
(1)“预处理”时,需用Na2CO3调节溶液至微酸性而不是碱性,其原因是__________________。
(2)“还原Ⅰ”需在80 ℃条件下进行,适宜的加热方式为____________。
(3)“还原Ⅱ”中,Cu2+参与反应的离子方程式为__________________。
(4)“搅拌”时加入NaCl粉末的作用是____________________________。
(5)“过滤Ⅱ”得到的Cu2Cl2需用无水乙醇洗涤,并在真空干燥机内于70 ℃干燥2小时,冷却,密封包装。于70 ℃真空干燥的目的是__________________________。
(6)①设计从“过滤Ⅰ”所得滤渣中获取Cu的实验方案:稀硫酸加到滤渣中,搅拌,充分反应至无气体产生为止,过滤并用蒸馏水洗涤2~3次,低温烘干。
②现欲测定途径a、b回收铜元素的回收率比,请补充实验方案:____________________,分别按途径a、b制取Cu和Cu2Cl2,测得Cu的质量为m1 g,Cu2Cl2的质量为m2 g,则途径a、b铜元素的回收率比为________(铜元素回收率=产品中铜元素质量/废液中铜元素的质量×100%)。
【答案】防止Cu2+形成沉淀 水浴加热 2Cu2++SO32-+2C1-+H2O=Cu2C12↓+SO42-+2H+ Cu2Cl2微溶于水,增大Cl-浓度,有利于Cu2Cl2析出(沉淀) 加快乙醇和水的挥发,防止Cu2Cl2被空气氧化 取两份相同体积的预处理后的水样 199m1:128m2
【解析】
刻蚀废液主要含CuCl2、FeCl3、FeCl2、HCl,结合后续流程可知,用Na2CO3调节溶液pH至微酸性而不是碱性,其目的是减小溶液中的氢离子浓度、防止Cu2+形成沉淀,减少后续反应中副反应的发生(铁与酸反应生成氢气、亚硫酸钠与酸反应生成二氧化硫)。途径a:加入过量的Fe,置换出Cu单质,过滤分离,滤液主要含有FeCl2,固体物质为Fe、Cu,用稀硫酸溶解Fe,再过滤、洗涤得到Cu;途径b:加入亚硫酸钠将Cu2+还原为Cu+,Cu+与C1-结合生成Cu2C12沉淀,据此解答。
(1)用Na2CO3调节溶液pH,使溶液中Fe3+转化为Fe(OH)3沉淀,而铜离子不能转化为沉淀,因此溶液调至微酸性而不是碱性的目的是减小溶液中的氢离子浓度、防止Cu2+形成沉淀,减少后续反应中副反应的发生(铁与酸反应生成氢气、亚硫酸钠与酸反应生成二氧化硫);
(2)在80℃条件下进行,可以利用水浴加热,受热均匀,便于控制温度;
(3)SO32-将Cu2+还原为Cu+,Cu+与C1-结合生成Cu2C12沉淀,反应的离子方程式为2Cu2++SO32-+2C1-+H2O=Cu2Cl2↓+SO42-+2H+;
(4)由于Cu2Cl2微溶于水,加入NaCl粉末,可增大C1-浓度,有利于Cu2Cl2析出;
(5)由于Cu2Cl2受潮后在空气中易被迅速氧化,于70℃真空干燥的目的是:加快乙醇和水的挥发,防止Cu2Cl2被空气氧化;
(6)欲测定途径a、b回收铜元素的回收率比,应该取用相同的起始原料,进行不同途径的处理,所以实验方案为:取两份相同体积的预处理后的水样。分别按途径a、b制取Cu和Cu2Cl2,测得Cu的质量为m1 g,Cu2Cl2的质量为m2 g,根据铜原子守恒可知途径a、b铜元素的回收率比等于途径a获得Cu的质量与途径b获得的Cu2Cl2中Cu元素质量之比,即途径a、b铜元素的回收率之比为:m1:128m2/199=199m1:128m2。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案