题目内容
【题目】将过量的CO2 分别通入:①CaCl2 溶液 ②NaAlO2 溶液 ③Ca(OH)2 溶液 ④饱和Na2CO3 溶液。最终溶液中有白色沉淀析出的是
A. ①③ B. ②④ C. ①②③ D. ②③
【答案】B
【解析】①CO2与CaCl2溶液不反应,①错误;②NaAlO2溶液中通入足量的CO2生成氢氧化铝白色沉淀和碳酸氢钠,②正确;③Ca(OH)2溶液中通入CO2首先生成碳酸钙沉淀,CO2过量后沉淀溶解生成碳酸氢钙,③错误;④饱和Na2CO3溶液中通入足量的CO2生成碳酸氢钠沉淀,④正确,答案选B。

【题目】1 000mL某待测液中除含有0.2mol,L-1的Na+外,还可能含有下列离子中的一种或多种:
阳离子 | K+、NH4+、Fe3+、Ba2+ |
阴离子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |
现进行如下实验操作(每次实验所加试剂均过量):
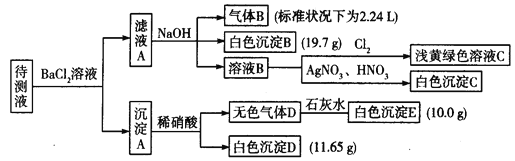
(1)写出生成白色沉淀B的离子方程式:__________________
(2)待测液中肯定不存在的阳离子是____________。
(3)若无色气体D是单一气体:
阴离子 | Cl- | Br- | CO32- | HCO3- | SO32- | SO42- |
浓度/mol.L — | ____ | ____ | ____ | ____ | ____ | ____ |
将阴离子的物质的量浓度填入上表中(一定不存在的填“0”,不能确定的填“?”):
②判断原溶液中K+是否存在,若存在,求其物质的量浓度的最小值,若不存在,请说明理由:______________
(4)若无色气体D是混合气体:
①待测液中一定含有的阴离子是______________。
②沉淀A中能与稀硝酸反应的成分是_______________(写化学式)。
【题目】化学计量在化学中占有重要地位,请回答下列问题:
(1)在标准状况下,CO和CO2的混合气体共33.6L,质量为50g。
①两种气体总的物质的量为 。② C与O原子个数比为 。
(2)实验室有一瓶失去标签的盐酸和一块镁铜合金,在0℃、1.01×105Pa时,分别向甲、乙、丙三个容器中加入100mL同浓度的盐酸后,再加入不同质量的同种粉末,得到的有关实验数据列于下表,请确定盐酸的浓度和合金的组成:
实验序号 | 甲 | 乙 | 丙 |
合金质量/g | 8.8 | 17.6 | 22.0 |
气体体积/L | 2.24 | 4.48 | 4.48 |
①下列的相关说法正确的是 (填序号)。
A.实验甲中,盐酸已完全反应
B.实验乙中,金属镁和盐酸恰好完全反应
C.若往实验丙的剩余物中添加盐酸,将继续产生氢气
D.金属铜参加反应并产生氢气
② 盐酸的物质的量浓度 ,合金中镁的质量分数 。

