题目内容
某种元素R的核外电子数等于核内中子数,取该元素5.6g跟氧气充分反应,可得到12g化合物RO2,则该种元素R在周期表中的位置是
| A.第二周期第ⅣA族 | B.第三周期第ⅣA族 |
| C.第三周期第ⅥA族 | D.第二周期第ⅥA族 |
B
试题分析:核外电子数等于核内中子数,则核外电子数就是质量数的一半,主要就是碳、硅两种元素。设该元素的质量数为M,那么相对原子质量也可以看做为M。则该元素单质物质的量为5.6/M mol,则最后得到的化合物也为5.6/M mol,则该化合物的相对分子质量为12*M/5.6。而从化合物组成出发,化合物的相对分子质量也可以通过M+32计算,所以得出等式:
12*M/5.6= M+32,解此式得到:M=28,则该元素为硅。位置在第三周期第ⅣA族
点评:本题的做法是先由核外电子数等于核内中子数来确定元素的范围,然后根据化合物相对分子质量来计算,当然此题也可以使用差量法。计算过程中注意细节。

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
 )如下表所示:
)如下表所示: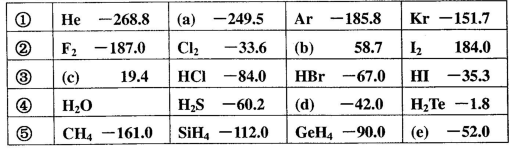
 、
、 、
、

