题目内容
实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸的浓度的实验:请完成下列填空:(1)配制100 mL 0.10 mol/L NaOH标准溶液。
①配制所需的玻璃仪器有:烧杯、量筒、玻璃棒、 、 等。
②称量 g氢氧化钠固体所需仪器有:天平(带砝码、镊子)、药匙、 。
(2)取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用 (填仪器名称)装配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
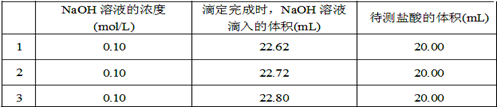
①滴定达到终点的标志是 。
②根据上述数据,可计算出该盐酸的浓度约为 (保留两位有效数字)。
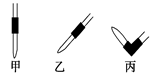
③排去碱式滴定管中气泡的方法应采用如图所示操作中的 ,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 。
E. 酸式滴定管使用前,水洗后未用待测盐酸润洗
①配制所需的玻璃仪器有:烧杯、量筒、玻璃棒、 、 等。
②称量 g氢氧化钠固体所需仪器有:天平(带砝码、镊子)、药匙、 。
(2)取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用 (填仪器名称)装配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。

①滴定达到终点的标志是 。
②根据上述数据,可计算出该盐酸的浓度约为 (保留两位有效数字)。
③排去碱式滴定管中气泡的方法应采用如图所示操作中的 ,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 。
| A.滴定终点读数时俯视读数 | B.碱式滴定管尖嘴部分有气泡,滴定后消失 |
| C.锥形瓶水洗后未干燥 | D.称量NaOH固体中混有Na2CO3固体 |
(1)①100 mL容量瓶 胶头滴管 ②0.4 烧杯(或表面皿)
(2)碱式滴定管①最后一滴NaOH溶液加入,溶液由无色恰好变成浅红色且半分钟内不褪色 ②0.11mol/L ③丙 ④B D
(2)碱式滴定管①最后一滴NaOH溶液加入,溶液由无色恰好变成浅红色且半分钟内不褪色 ②0.11mol/L ③丙 ④B D
试题分析:(1)配制100 mL 0.10 mol/L NaOH标准溶液需要的仪器有烧杯、量筒、玻璃棒、100 mL容量瓶、胶头滴管;100 mL 0.10 mol/L NaOH中含有的NaOH的质量m=0.10×100/1000×40g=0.4g,所以应该称取0.4g氢氧化钠固体,由于氢氧化钠易潮解,故需要使用烧杯(或表面皿);(2)标准液NaOH溶液应该装在碱式滴定管中,不能用酸式滴定管;①该滴定实验室用标准氢氧化钠溶液滴定酸,故其滴定终点是最后一滴NaOH溶液加入,溶液由无色恰好变成浅红色且半分钟内不褪色;②根据上述数据,可计算出该盐酸的浓度约为(22.62+22.72+22.80)/3×0.10/20=0.11mol/L;③排去碱式滴定管中气泡的方法应采用丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液;④滴定终点读数时俯视读数,即导致读数比实际消耗的体积小,故测定的酸的浓度偏小,故A不能选;碱式滴定管尖嘴部分有气泡,滴定后消失,即导致读数比实际消耗的大,故测定的酸的浓度偏高,故B可以选择;锥形瓶水洗后未干燥,对结果么有影响,故C不能选;配制标准溶液的氢氧化钠中混有Na2CO3杂质,由于氢氧化钠的性对分子量为40,而碳酸钠的性对分子量为100,而消耗盐酸时两个氢氧化钠分子与一个碳酸钠分子相同,故折算起来的标准的氢氧化钠的浓度偏小,所以测定的结果就偏高,故D可以选择;酸式滴定管使用前,水洗后未用待测盐酸润洗,故测定的酸的浓度偏低,故本题的答案选择BD。
点评:本题考查了溶液的配置、酸碱滴定的相关知识,该考点是高考考查的重点和难点,本题有一定能够的综合性,该题有利于培养学生的分析能力,本题难度中等。

练习册系列答案
相关题目

 浸出液
浸出液
 滤液
滤液
 ZnO
ZnO