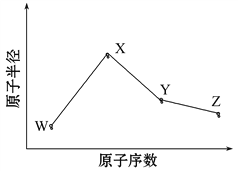
题目内容
【题目】Na、Mg、Al各1mol分别与50mL2mol/L的硫酸溶液反应,下列说法正确的是( )
A.镁铝产生的氢气一样多
B.钠放出氢气最多
C.铝最终产生氢气最多
D.产生氢气的量无法比较
【答案】A,B
【解析】Na、Mg、Al各1mol,硫酸的物质的量是0.05L×2mol/L=0.1mol,根据电子得失守恒可知2Na~H2SO4~H2,2Mg~2H2SO4~2H2,2Al~3H2SO4~3H2,因此硫酸均不足量,硫酸完全反应,Mg、Al生成氢气为0.1mol,钠过量,但过量的钠和水反应,1mol钠可生成0.5mol氢气,所以镁铝产生的氢气一样多,钠生成氢气最多。
所以答案是:AB

练习册系列答案
相关题目