题目内容
(14分) 在25℃时,向100 mL含氯化氢14.6 g的盐酸溶液里放入5.60 g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2 min末,收集到1.12 L(标准状况)氢气。在此之后,又经过4 min,铁粉完全溶解。则:
①在前2 min内用FeCl2表示的平均反应速率是 。
②在后4 min内用HCl表示的平均反应速率是 。
③ 前2 min与后4 min相比,反应速率较快的是 ,其原因是 。
(2)已知有一组数据:破坏1mol氢气中的化学键需要吸收436kJ能量;破坏0.5mol氧气中的O=O键需要吸收249kJ的能量;形成水分子中1 molH—O键能够释放463kJ能量。下图表示氢气和氧气反应过程中能量的变化,请将图中①、②、③的能量变化的数值,填在下边的横线上。

① kJ ② kJ ③ kJ
①在前2 min内用FeCl2表示的平均反应速率是 。
②在后4 min内用HCl表示的平均反应速率是 。
③ 前2 min与后4 min相比,反应速率较快的是 ,其原因是 。
(2)已知有一组数据:破坏1mol氢气中的化学键需要吸收436kJ能量;破坏0.5mol氧气中的O=O键需要吸收249kJ的能量;形成水分子中1 molH—O键能够释放463kJ能量。下图表示氢气和氧气反应过程中能量的变化,请将图中①、②、③的能量变化的数值,填在下边的横线上。

① kJ ② kJ ③ kJ
(14分)(1)①0.25 mol?L-1?min-1 ②0.25 mol?L-1?min-1 (每空2分)
③前2 min ;随着反应的进行,反应物浓度减小,反应速率减慢(每空2分)
(2)① 1370 ② 1852 ③ 482 (每空2分)
③前2 min ;随着反应的进行,反应物浓度减小,反应速率减慢(每空2分)
(2)① 1370 ② 1852 ③ 482 (每空2分)
(1)①反应开始至2 min末,收集到1.12 L(标准状况)氢气,则氢气的物质的量是0.05mol。根据方程式2HCl+Fe=FeCl2+H2↑,生成硫化亚铁是0.05mol,其浓度是0.5mol/L,所以用硫化亚铁表示的反应速率是0.5mol/L÷2min=0.25 mol?L-1?min-1 。
②氯化氢的物质的量是0.4mol,而铁是0.1mol,所以在后4 min内用消耗氯化氢的物质的量是(0.1mol-0.05mol)×2=0.1mol,浓度是0.1mol÷0.1L=1.0mol/L,所以用氯化氢表示的反应速率是1.0mol/L÷4min=0.25 mol?L-1?min-1 。
③根据①②可知,前2 min与后4 min相比,反应速率较快的是前2min。这是由于随着反应的进行,反应物氢离子的浓度逐渐减小,反应速率逐渐减慢。
(2)根据图像可知,①表示断键吸收的能量,因此是436kJ×2+249kJ×2=1370kJ;②表示形成化学键所放出的能量,所以应该是463kJ×2×2=1852kJ,因此该反应实际放出的热量是1852kJ-1370kJ=482kJ。
②氯化氢的物质的量是0.4mol,而铁是0.1mol,所以在后4 min内用消耗氯化氢的物质的量是(0.1mol-0.05mol)×2=0.1mol,浓度是0.1mol÷0.1L=1.0mol/L,所以用氯化氢表示的反应速率是1.0mol/L÷4min=0.25 mol?L-1?min-1 。
③根据①②可知,前2 min与后4 min相比,反应速率较快的是前2min。这是由于随着反应的进行,反应物氢离子的浓度逐渐减小,反应速率逐渐减慢。
(2)根据图像可知,①表示断键吸收的能量,因此是436kJ×2+249kJ×2=1370kJ;②表示形成化学键所放出的能量,所以应该是463kJ×2×2=1852kJ,因此该反应实际放出的热量是1852kJ-1370kJ=482kJ。

练习册系列答案
相关题目
 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。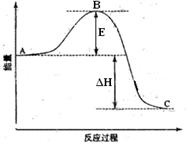
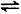 2SO3(g) ?Η=-197kJ/mol。在此温度下,向甲、乙两个固定容积的密闭容器中分别通入2molSO2、1molO2和1mol SO2、0.5molO2,反应达到平衡状态时放出的热量分别为Q甲和Q乙,则下列关系正确的是
2SO3(g) ?Η=-197kJ/mol。在此温度下,向甲、乙两个固定容积的密闭容器中分别通入2molSO2、1molO2和1mol SO2、0.5molO2,反应达到平衡状态时放出的热量分别为Q甲和Q乙,则下列关系正确的是
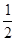 O2(g) == H2O(l) △H3=-285.8kJ·mol-1
O2(g) == H2O(l) △H3=-285.8kJ·mol-1