题目内容
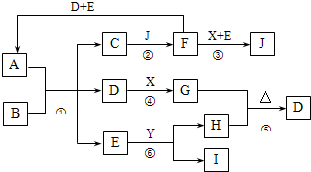 A是由四种短周期元素组成的正盐,X是黄绿色气体,D、F都是无色有刺激性气味的气体;气体I对H2的相对密度是13,且分子中各原子处于同一直线上;D、E分子都是10电子微粒.转化关系如下(部分产物省略):
A是由四种短周期元素组成的正盐,X是黄绿色气体,D、F都是无色有刺激性气味的气体;气体I对H2的相对密度是13,且分子中各原子处于同一直线上;D、E分子都是10电子微粒.转化关系如下(部分产物省略):请回答下列问题:
(1)J的化学式为
H2SO4或HCl
H2SO4或HCl
,I的结构式(或电子式)为H-C≡C-H
H-C≡C-H
.(2)反应⑤的化学方程式是:
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
| ||
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
.
| ||
(3)上述转化中,属于氧化还原反应的是(填编号)
③④
③④
.反应④的现象产生大量白烟
产生大量白烟
(4)在450℃、催化剂存在下,4 mol F和2 mol O2反应放热353.9 kJ,此时,F的转化率为90%,则该反应的热化学方程式为:
2SO2(g)+O2(g)
2SO3(g)△H=-196.6 kJ?mol-1
| ||
| △ |
2SO2(g)+O2(g)
2SO3(g)△H=-196.6 kJ?mol-1
.
| ||
| △ |
分析:X是黄绿色气体判断为Cl2,D、F都是无色有刺激性气味的气体;气体I对H2的相对密度是13说明I相对分子质量为26,分子中各原子处于同一直线上.证明是乙炔气体,D、E分子都是10电子微粒,判断E为H2O,Y为CaC2,H为Ca(OH)2;D气体是由H(Ca(OH)2)和G加热反应生成,判断D为NH3,G为NH4Cl,A是由四种短周期元素组成的正盐,D、F都是无色有刺激性气味的气体,F和Cl2,H2O反应,F和NH3,H2O反应,说明F是酸性气体,又是还原性气体,判断F为SO2,A为(NH4)2SO3,B为强碱,C为亚硫酸盐,J为盐酸或硫酸;依据分析判断出各物质进行分析回答;
解答:解:X是黄绿色气体判断为Cl2,D、F都是无色有刺激性气味的气体;气体I对H2的相对密度是13说明I相对分子质量为26,分子中各原子处于同一直线上.证明是乙炔气体,D、E分子都是10电子微粒,判断E为H2O,Y为CaC2,H为Ca(OH)2;D气体是由H(Ca(OH)2)和G加热反应生成,判断D为NH3,G为NH4Cl,A是由四种短周期元素组成的正盐,D、F都是无色有刺激性气味的气体,F和Cl2,H2O反应,F和NH3,H2O反应,说明F是酸性气体,又是还原性气体,判断F为SO2,A为(NH4)2SO3,B为强碱,C为亚硫酸盐,J为盐酸或硫酸;
(1)依据上述推断,J为H2SO4或HCl,I的结构式为:H-C≡C-H;故答案为:H2SO4或HCl
(2)反应⑤是氯化铵和氢氧化钙加热制备氨气的 反应,反应的化学方程式是:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;
(3)上述反应中①②⑤⑥是复分解反应,③是二氧化硫被氯气氧化的氧化还原反应,④是氨气被氯气氧化的反应属于氧化还原反应;属于氧化还原反应的是:③④;反应④的反应为:氯气和氨气反应生成氮气和氯化铵固体,现象为:产生大量白烟;故答案为:③④;产生大量白烟;
(4)在450℃、催化剂存在下,4 mol F(SO2)和2 mol O2反应放热353.9 kJ,此时,F的转化率为90%,换算为2mol二氧化硫完全反应时放热多少,结合热化学方程式的书写原则写出,4molSO2,转化了4mol×90%=3.6mol,放热353.9 kJ,2molSO2全部反应放热为196.6KJ,则该反应的热化学方程式为:2SO2(g)+O2(g)
2SO3(g)△H=-196.6 kJ?mol-1 ;
故答案为:2SO2(g)+O2(g)
2SO3(g)△H=-196.6 kJ?mol-1
(1)依据上述推断,J为H2SO4或HCl,I的结构式为:H-C≡C-H;故答案为:H2SO4或HCl
(2)反应⑤是氯化铵和氢氧化钙加热制备氨气的 反应,反应的化学方程式是:2NH4Cl+Ca(OH)2
| ||
| ||
(3)上述反应中①②⑤⑥是复分解反应,③是二氧化硫被氯气氧化的氧化还原反应,④是氨气被氯气氧化的反应属于氧化还原反应;属于氧化还原反应的是:③④;反应④的反应为:氯气和氨气反应生成氮气和氯化铵固体,现象为:产生大量白烟;故答案为:③④;产生大量白烟;
(4)在450℃、催化剂存在下,4 mol F(SO2)和2 mol O2反应放热353.9 kJ,此时,F的转化率为90%,换算为2mol二氧化硫完全反应时放热多少,结合热化学方程式的书写原则写出,4molSO2,转化了4mol×90%=3.6mol,放热353.9 kJ,2molSO2全部反应放热为196.6KJ,则该反应的热化学方程式为:2SO2(g)+O2(g)
| ||
| △ |
故答案为:2SO2(g)+O2(g)
| ||
| △ |
点评:本题考查了物质转化关系和物质性质的综合应用,主要考查乙炔气体的制备,氨气实验室制备,氧化还原反应的判断,化学平衡的理解,热化学方程式的书写,乙炔制备反应和二氧化硫的判断是解题关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
如下图所示的转化关系中(部分产物省略),A是由四种短周期元素组成的正盐,X是黄绿色气体,D、F都是无色有刺激性气味的气体;气体I对H2的相对密度是13,且分子中各原子处于同一直线上;D、E分子都是10电子微粒。
 |
![]()
请回答下列问题:
(1)J的化学式为 ,Y的电子式为 。
(2)反应③的离子方程式是 ,反应⑤的化学方程式是 。
(3)上述转化中,属于氧化还原反应的是(填编号) 。
(4)在450 ℃、催化剂存在下,4 mol F和2 mol O2反应放热353.9 kJ,此时,F的转化率为90 %,则该反应的热化学方程式为 。

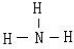
 A是由四种短周期元素组成的正盐,X是黄绿色气体,D、F都是无色有刺激性气味的气体;气体I对H2的相对密度是13,且分子中各原子处于同一直线上;D、E分子都是10电子微粒.转化关系如下(部分产物省略):
A是由四种短周期元素组成的正盐,X是黄绿色气体,D、F都是无色有刺激性气味的气体;气体I对H2的相对密度是13,且分子中各原子处于同一直线上;D、E分子都是10电子微粒.转化关系如下(部分产物省略):