题目内容
【题目】氯化亚铜常用作有机合成工业中的催化剂,为白色晶体,不溶于乙醇,微溶于水,易溶于浓盐酸形成络合离子[CuCl2]﹣ . 受潮露置空气中迅速氧化成碱式盐.实验室用下列流程制备: 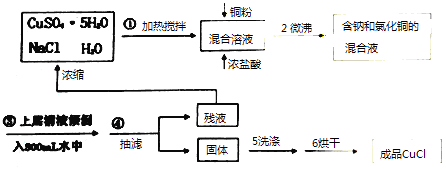
注:①实验药品:硫酸铜晶体12.5g、氯化钠晶体6.0g、水200mL、铜粉3.5g、浓盐酸10mL.
②Na[CuCl2](易电离,溶液无色) ![]() NaCl+CuCl↓ (白色沉淀).
NaCl+CuCl↓ (白色沉淀).
请回答:
(1)写出实验室制取Na[CuCl2]的离子方程式 .
(2)判断步骤②反应完全的现象是 .
(3)步骤④有关抽滤操作,下列说法正确的是 .
A.选择抽滤主要是为了加快过滤速度,得到较干燥的沉淀
B.在吸滤瓶和抽气泵之间应连接一个安全瓶,吸滤瓶应与安全瓶的长导管相接
C.抽滤时不宜过滤胶状沉淀,否则易在滤纸上形成一层密实的沉淀
D.洗涤沉淀时,应关小水龙头,使洗涤剂缓缓通过沉淀物
(4)步骤⑤用乙醇的水溶液洗涤的目的是 .
(5)步骤⑥烘干须在真空干燥箱中进行,其原因是 .
(6)氯化亚铜的定量分析:
①取样品0.25g和10mL过量的FeCl3溶液于250mL锥形瓶中,充分溶解.
②用0.10molL﹣1硫酸锶铈标准溶液滴定.
已知:CuCl+FeCl3=CuCl2+FeCl2; Fe2++Ce4+=Fe3++Ce3+三次平行试验结果如下(平行试验结果相差不能超过1%):
平行试验次数 | 1 | 2 | 3 |
0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
则样品中CuCl的纯度为 . (结果保留三位有效数字)
【答案】
(1)Cu2++4Cl﹣+Cu=2[CuCl2]﹣
(2)反应溶液由蓝色转变成无色透明时为止
(3)AD
(4)水洗涤除去氯化亚铜表面吸附的杂质,提高产品纯度,同时减少产品的溶解,减少损失
(5)氯化亚铜在潮湿的空气中能迅速氧化生成碱式盐而变质
(6)95.5%
【解析】解:硫酸铜晶体、NaCl和水加热搅拌,然后向混合溶液中加入Cu、浓盐酸,发生的离子反应方程式为 Cu2++4Cl﹣+Cu=2[CuCl2]﹣ , 微沸得到含有钠和氯化铜的混合溶液,将上层溶液倒入水中,发生的反应为Na[CuCl2](易电离,溶液无色) ![]() NaCl+CuCl↓,然后抽滤得到固体CuCl和残液,残液中含有氯化钠、硫酸铜,将固体洗涤、烘干得到成品CuCl,(1)硫酸铜、浓盐酸和Cu能反应生成Na[CuCl2],离子反应方程式为Cu2++4Cl﹣+Cu=2[CuCl2]﹣ , 所以答案是:Cu2++4Cl﹣+Cu=2[CuCl2]﹣;(2)铜离子为蓝色,Na[CuCl2]为无色,如果步骤②反应完全,则溶液中不存在铜离子的颜色,所以判断反应完全的现象为反应溶液由蓝色转变成无色透明时为止,
NaCl+CuCl↓,然后抽滤得到固体CuCl和残液,残液中含有氯化钠、硫酸铜,将固体洗涤、烘干得到成品CuCl,(1)硫酸铜、浓盐酸和Cu能反应生成Na[CuCl2],离子反应方程式为Cu2++4Cl﹣+Cu=2[CuCl2]﹣ , 所以答案是:Cu2++4Cl﹣+Cu=2[CuCl2]﹣;(2)铜离子为蓝色,Na[CuCl2]为无色,如果步骤②反应完全,则溶液中不存在铜离子的颜色,所以判断反应完全的现象为反应溶液由蓝色转变成无色透明时为止,
所以答案是:反应溶液由蓝色转变成无色透明时为止;(3)A.颗粒太小的沉淀易在滤纸上形成一层密实的沉淀,溶液不易透过,则选择抽滤主要是为了加快过滤速度,得到较干燥的沉淀,故A正确;
B.在吸滤瓶和抽气泵之间应连接一个安全瓶,吸滤瓶应与安全瓶的短导管相接,否则易使水进入安全瓶,故B错误;
C.胶状沉淀易透过滤纸而不易采用抽滤方法,故C错误;
D.在洗涤沉淀时,应关小水龙头,使洗涤剂缓缓通过沉淀物,防止沉淀溶解而造成损失,故D正确;
故选AD;(4)CuCl不溶于乙醇而微溶于水,水洗涤除去氯化亚铜表面吸附的杂质,提高产品纯度,同时减少产品的溶解,减少损失,所以用乙醇的水溶液洗涤,
所以答案是:水洗涤除去氯化亚铜表面吸附的杂质,提高产品纯度,同时减少产品的溶解,减少损失;(5)氯化亚铜受潮露置空气中迅速氧化成碱式盐,为防止被氧化,步骤⑥烘干须在真空干燥箱中进,
所以答案是:氯化亚铜在潮湿的空气中能迅速氧化生成碱式盐而变质;(6)因为第一次消耗体积与第二次和第三次相差较大,舍去,消耗硫酸铈溶液的平均体积= ![]() mL=24.00mL,
mL=24.00mL,
n(Ce4+)=0.10mol/L×0.024L=0.0024mol,根据Fe2++Ce4+=Fe3++Ce3+、CuCl+FeCl3=CuCl2+FeCl2得
n(CuCl)=n(Fe2+)=n(Ce4+)=0.0024mol,
则m(CuCl)=0.0024mol×99.5g/mol=0.2388g,
样品中CuCl的纯度= ![]() =95.5%,
=95.5%,
所以答案是:95.5%.

 名校课堂系列答案
名校课堂系列答案