题目内容
【题目】海洋是一个巨大的宝藏,期待着人们的开发和利用。
Ⅰ.(1)利用海水可以得到食盐,从海水中得到食盐的变化是___变化。(填“物理”或“化学”)
(2)要除去某食盐晶体中的CaCl2、MgCl2、Na2SO4等杂质,有以下操作:
A.蒸发结晶 B.过滤 C.加入过量的Na2CO3溶液 D.加水溶解 E.加入过量的烧碱溶液 F.加入过量稀盐酸 G.加入过量的Ba(NO3)2溶液 H.加入过量的稀硝酸 I.加入过量的BaCl2溶液
正确的操作顺序是:__→E→___→C→__→__→A
Ⅱ.海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图所示:
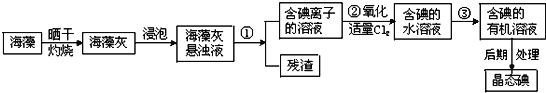
(1)指出提取碘的过程中有关的实验操作名称:①___③___。
(2)操作③中可以选择的有机试剂为___,选择该试剂时,水层在___层(填 “上”或“下”),含碘溶液应从___(获得填“容器上口”或“容器下口”),要从碘的有机溶液中获得碘单质,应采用___的操作(填一种实验操作方法)。
【答案】物理 D I B F 过滤 萃取、分液 四氯化碳 上 容器下口 蒸馏
【解析】
Ⅰ.(1)海水经过晒盐,可得到食盐;
(2)除杂的原则:不增:不增加新的杂质;不减:不减少被提纯物质;易分离:杂质与被提纯物质容易分离,根据不同离子的特性,选择合适的试剂和顺序,注意所加试剂必须过量;
Ⅱ.(1)分离固体和液体用过滤,利用溶解性的差异来分析;碘离子转化为碘的有机溶液,需要用到分液;
(2)常用的萃取剂为四氯化碳,其密度比水大,萃取后再进行蒸馏提取碘单质。
Ⅰ. 把海水经太阳暴晒,蒸发水分后即得食盐,不需要化学变化就能够从海水中获得,该方法属于物理变化,故答案为:物理;
(2)NaOH与MgCl2反应,除去Mg2+,过量后可以用盐酸除去;BaCl2与Na2SO4反应,除去SO42,过量后可用Na2CO3溶液除去;Na2CO3与BaCl2、CaCl2反应,除去Ca2+、Ba2+;盐酸与NaOH溶液、Na2CO3反应,除去过量的OH、CO32,最后经过滤除去沉淀,然后蒸发,过量的HCl随水分蒸发掉,得到纯净的食盐,顺序为D→E→I→C→B→F→A,
故答案为:D;I;B;F;
Ⅱ.:(1) ①分离含碘离子的溶液和残渣,其操作名称为过滤;碘单质易溶于有机溶剂,将碘水中的碘单质萃取到有机溶剂中,因此该操作步骤为萃取、分液,
故答案为:过滤;萃取、分液;
(2)操作③中可以选择的有机试剂为四氯化碳,因四氯化碳的密度比水大,故水层在上层,含碘溶液应从容器下口获得,最后经过蒸馏操作获取碘单质,故答案为:四氯化碳;上;容器下口;蒸馏。

【题目】氨气是一种重要化工原料。
(1)德国化学家哈伯从1902年开始研究由氮气和氢气直接合成氨。
已知:①![]() △H=a kJ/mol
△H=a kJ/mol
②每破坏lmol有关化学键需要的能量如下表:
H-H | N-H | N≡N |
436kJ | 391kJ | 946k |
则a=_________________。
(2)下图为不同温度(T)、不同投料比[n(![]() )/n(
)/n(![]() )]时反应达到平衡时
)]时反应达到平衡时![]() 的转化率变化曲线。
的转化率变化曲线。
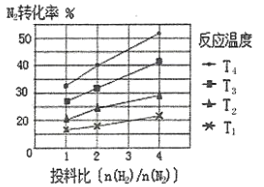
①![]() 、
、![]() 、
、![]() 、
、![]() 的大小关系为__________________。
的大小关系为__________________。
②保持温度和体积不变,提高投料比[n(![]() )/n(
)/n(![]() )],则重新达到平衡时,下列说法一定正确的是_______(填字母序号)。
)],则重新达到平衡时,下列说法一定正确的是_______(填字母序号)。
A.![]() 的浓度增大
的浓度增大
B.![]() 的转化率增大
的转化率增大
C.![]() 的体积分数增大
的体积分数增大
D.![]() 的浓度减小
的浓度减小
③温度为![]() 时,向2L密闭容器中加入1.0mol
时,向2L密闭容器中加入1.0mol![]() 和1.0mol
和1.0mol![]() ,若5min后反应达到平衡,则用v(
,若5min后反应达到平衡,则用v(![]() )表示该反应的平均速率为____________________;反应在
)表示该反应的平均速率为____________________;反应在![]() 时的平衡常数K=________________。
时的平衡常数K=________________。
(3)一种新型除烟气中氮氧化物的方法是采用![]() 作还原剂还原烟气中的氮氧化物且产物无污染,写出
作还原剂还原烟气中的氮氧化物且产物无污染,写出![]() 还原
还原![]() 的化学反应方程式_____________________________________。
的化学反应方程式_____________________________________。
(4)若用标准盐酸测定某稀氨水的浓度,应选择__________作指示剂;滴定过程中眼睛注视_____________。已知稀氨水体积为25.0mL,滴定结束测得消耗0.0100mol/L盐酸的平均体积为20.0mL,则该氨水的浓度为________________(保留2位有效数字);若滴定前滴定管尖嘴有气泡,滴定后尖嘴无气泡,则测定结果________(填“偏大”、“偏小”、“不变”)。