题目内容
【题目】一种回收并利用含碘(I-)废液(废液中杂质沉淀后进入滤液中)的工艺流程如下:
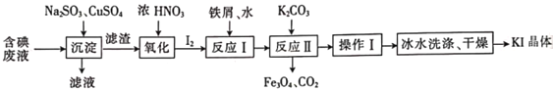
(1)“沉淀”后滤渣为______________________(填化学式,其中滤渣中Cu元素为+1价)
(2)“氧化”反应的离子方程式为______________________。
(3)反应I中只生成化合物FexIy(其中I与Fe的质量比为127︰21),反应中铁屑是___________(填“氧化剂”“还原剂”或“催化剂”,下同),水是___________。反应消耗的铁与转移电子的物质的量之比为___________。
(4)反应Ⅱ的化学方程式为_________________________________。
(5)操作I除蒸发皿、酒精灯外还需用到的玻璃仪器有______________________。冰水洗涤的目的是_________________________________。
【答案】CuI 2CuI+4NO3-+8H+=2Cu2++I2+4NO2↑+4H2O 还原剂 催化剂 3:8 Fe3I8+4K2CO3=Fe3O4+8KI+4CO2↑ 玻璃棒、漏斗、烧杯 除去KI表面的可溶性杂质,同时减少其溶解损失
【解析】
结合流程可以知道回收废液中碘离子的步骤为:先向废液中加入亚硫酸钠、硫酸铜溶液生成CuI沉淀,过滤得到滤渣CuI,然后加入浓硝酸氧化CuI,向氧化产物碘单质中加入铁屑和水后得到FexIy,FexIy与碳酸钾溶液反应生成Fe3O4、KI和CO2;过滤后将反应Ⅱ的滤液经过加热浓缩、冷却结晶、过滤,初步得到碘化钾;因为碘化钾混有可溶性杂质,需要经过洗涤才能得到较纯净的产品,同时为了减少KI的溶解损失,需要用冰水洗涤,最后得到纯净的碘化钾,据此分析。
结合流程可以知道回收废液中碘离子的步骤为:先向废液中加入亚硫酸钠、硫酸铜溶液生成CuI沉淀,过滤得到滤渣CuI,然后加入浓硝酸氧化CuI,向氧化产物碘单质中加入铁屑和水后得到FexIy,FexIy与碳酸钾溶液反应生成Fe3O4、KI和CO2;过滤后将反应Ⅱ的滤液经过加热浓缩、冷却结晶、过滤,初步得到碘化钾;因为碘化钾混有可溶性杂质,需要经过洗涤才能得到较纯净的产品,同时为了减少KI的溶解损失,需要用冰水洗涤,最后得到纯净的碘化钾。
(1)由于滤渣中Cu为+1价,“沉淀”后滤渣为CuI;
(2)“氧化”时是滤渣与浓硝酸反应生成硝酸铜、碘、二氧化氮和水,反应的离子方程式为2CuI+4NO3-+8H+=2Cu2++I2+4NO2↑+4H2O;
(3)反应I中铁由单质变为铁的化合物,化合价升高,作为还原剂;加入水可以加快反应速率,水起到了催化剂的作用,水是催化剂;在反应中生成铁与碘的化合物,其中铁元素与碘元素的质量比为21:127,即Fe与I物质的量之比为:![]() :
:![]() =3:8,反应Ⅰ生成物化学式是 Fe3I8,根据碘的化合价,碘的化合价由0价变为-1价,则反应消耗的铁与转移电子的物质的量之比为3:8;
=3:8,反应Ⅰ生成物化学式是 Fe3I8,根据碘的化合价,碘的化合价由0价变为-1价,则反应消耗的铁与转移电子的物质的量之比为3:8;
(4)根据流程Fe3I8与碳酸钾溶液反应生成Fe3O4、KI和CO2,反应Ⅱ的化学方程式为Fe3I8+4K2CO3=Fe3O4+8KI+4CO2↑;
(5)操作I包括蒸发浓缩、冷却结晶、过滤,除蒸发皿、酒精灯外,还需用到的玻璃仪器有玻璃棒、漏斗、烧杯;冰水洗涤的目的是除去KI表面的可溶性杂质,同时减少其溶解损失。

【题目】实验是化学学习中非常重要的内容,根据下面两个实验回答问题。
(一)某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
(查阅资料)25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38
(实验探究)向2支均盛有1mL0.1mol/LMgCl2溶液的试管中分别加入2滴2mol/L NaOH溶液,制得等量Mg(OH)2沉淀。
(1)分别向两支试管中加入不同试剂,记录实验现象如表:(表中填空填下列选项中字母代号)
试管编号 | 加入试剂 | 实验现象 |
Ⅰ | 2滴0.1mol/LFeCl3溶液 | ①_____ |
Ⅱ | 4mL2mol/LNH4Cl溶液 | ②_____ |
A.白色沉淀转化为红褐色沉淀 B.白色沉淀不发生改变
C.红褐色沉淀转化为白色沉淀 D.白色沉淀溶解,得无色溶液
(2)同学们猜想实验Ⅱ中沉淀溶解的主要原因有两种:
猜想1:NH4+结合Mg(OH)2电离出的OH-,使Mg(OH)2的溶解平衡正向移动。
猜想2:____________________________________________________________。
(3)为验证猜想,同学们取少量相同质量的氢氧化镁盛放在两支试管中,一支试管中加入醋酸铵溶液(pH=7),另一支试管中加入NH4Cl和氨水混合液(pH=8),两者沉淀均溶解。该实验证明猜想正确的是____(填 “1”或“2”)。
(二)测定某品牌的碘盐(含有碘酸钾)中碘元素的百分含量。准确称取5.000 0 g该碘盐,溶于蒸馏水,然后与足量的KI溶液在酸性条件下混合(发生的反应为KIO3+3H2SO4+5KI===3K2SO4+3I2+3H2O),充分反应后将混合溶液稀释至250 mL,然后取25.00 mL用5.0×10-4 mol·L-1的Na2S2O3标准溶液进行滴定(用淀粉作指示剂,反应为I2+2S2O32-===2I-+S4O62-)。有关实验数值如下表所示。
滴定次数 | 待测液的体积(mL) | 滴定前的读数(mL) | 滴定后的读数(mL) |
第一次 | 25.00 | 0.00 | 15.90 |
第二次 | 25.00 | 0.00 | 14.99 |
第三次 | 25.00 | 0.00 | 15.01 |
该碘盐中碘元素的百分含量为________。(保留三位有效数字)下列操作中,会导致所测得的碘元素的百分含量偏大的是________。
a.滴定终时,俯视刻度
b.没有用Na2S2O3标准溶液润洗相应的滴定管
c.锥形瓶中有少量的蒸馏水