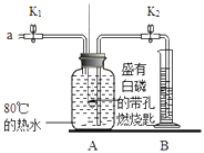
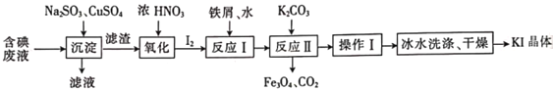
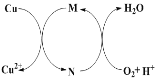题目内容
【题目】现将 2 mol 气体A 与 1 mol 气体B 充入一个体积不变的容器内,发生反应:2A+B C+3D+4E,达到平衡后气体A 的浓度减少一半,发现有液体生成,在相同的温度下测得反应 前后压强分别为 6.06×106 Pa 和 8.08×106 Pa,又测得反应共放出热量 Q kJ,下列说法正确的是( )
A. 该反应在任何温度下都可自发进行
B. 在上述平衡体系中再加入 1 mol A 和 0.5 mol B,平衡正向移动,A 的转化率增大
C. 该反应的热化学方程式为 2A(g)+B(g) C(g)+3D(l)+4E(g) ΔH= -Q kJ/mol
D. 上述反应达到平衡后,其他的条件不变的情况下,升高温度,压强一定增大
【答案】A
【解析】
恒温恒容条件下,反应前后气体总压强之比等于其物质的量之比,则反应后混合气体物质的量=![]() ×3mol=4mol,达到平衡时A的浓度减小一半,说明A的物质的量减小一半,即有1molA反应,则有0.5molB反应,生成0.5molC、1.5molD、2molE,故D为液体、C和E为气体。
×3mol=4mol,达到平衡时A的浓度减小一半,说明A的物质的量减小一半,即有1molA反应,则有0.5molB反应,生成0.5molC、1.5molD、2molE,故D为液体、C和E为气体。
A.该反应的焓变小于0,熵变大于0;
B.在上述平衡体系中再加入1molA和0.5molB,相当于增大压强,平衡向气体体积减小的方向移动;
C.有1molA反应放出QkJ热量,则2molA完全反应放出2QkJ热量;
D.该反应中放出热量,则正反应是放热反应,反应前后气体压强增大,则反应前后气体物质的量之和增大。
恒温恒容条件下,反应前后气体总压强之比等于其物质的量之比,则反应后混合气体物质的量=![]() ×3mol=4mol,达到平衡时A的浓度减小一半,说明A的物质的量减小一半,即有1molA反应,则有0.5molB反应,生成0.5molC、1.5molD、2molE,故D为液体,C和E为气体。
×3mol=4mol,达到平衡时A的浓度减小一半,说明A的物质的量减小一半,即有1molA反应,则有0.5molB反应,生成0.5molC、1.5molD、2molE,故D为液体,C和E为气体。
A.该反应的焓变小于0,熵变大于0,则△G=△H-T△S<0,该反应在任何温度下都可自发进行,选项A正确;
B.在上述平衡体系中再加入1molA和0.5molB,相当于增大压强,平衡向气体体积减小的方向移动,即逆向移动,A的转化率减小,选项B错误;
C.有1molA反应放出QkJ热量,则2molA完全反应放出2QkJ热量,且反应前后压强之比为3:4,气体的物质的量之比为3:4,D应该是液体,其热化学方程式为2A(g)+B(g) C(g)+3D(l)+4E(g)△H=-2QkJ/mol,选项C错误;
D.该反应中放出热量,则正反应是放热反应,反应前后气体压强增大,则反应前后气体物质的量之和增大,升高温度平衡逆向移动,气体的物质的量减小,根据PV=nRT可以判断,压强不一定增大,选项D错误;
答案选A。

 快捷英语周周练系列答案
快捷英语周周练系列答案【题目】研究煤的合理利用及CO2的综合应用有着重要的意义。请回答以下问题:
Ⅰ.煤的气化
已知煤的气化过程涉及的基本化学反应有:
①C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+131 kJ/mol
CO(g)+H2(g) ΔH=+131 kJ/mol
②CO(g)+3H2(g)![]() CH4(g)+H2O(g) ΔH=a kJ/mol
CH4(g)+H2O(g) ΔH=a kJ/mol
查阅资料反应②中相关化学键键能数据如下表:
化学键 | C≡O | H-H | H-C | H-O |
E/(kJ/mol) | 1072 | 436 | 414 | 465 |
(1)则反应②中a=______。
(2)煤直接甲烷化反应C(s)+2H2 (g)![]() CH4(g)的ΔH为______kJ/mol,该反应在______(填“高温”或“低温”)下自发进行。
CH4(g)的ΔH为______kJ/mol,该反应在______(填“高温”或“低温”)下自发进行。
Ⅱ.合成低碳烯烃
在体积为1 L的密闭容器中,充入1 mol CO2和2.5 mol H2,发生反应: 2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH=-128 kJ/mol,测得温度对催化剂催化效率和CO2平衡转化率的影响如右图所示:
C2H4(g)+4H2O(g) ΔH=-128 kJ/mol,测得温度对催化剂催化效率和CO2平衡转化率的影响如右图所示:
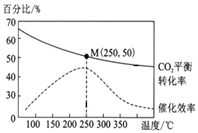
(3)图中低温时,随着温度升高催化剂的催化效率提高,但CO2的平衡转化率却反而降低,其原因是______。
(4)250℃时,该反应的平衡常数K值为______。
Ⅲ.合成甲醇
在恒温2 L容积不变的密闭容器中,充入1 molCO2和3 molH2,发生反应:CO2(g)+3H2(g) ![]() CH3OH(g) +H2O(g) ,测得不同时刻反应前后容器内压强变化(p后/p前)如下表:
CH3OH(g) +H2O(g) ,测得不同时刻反应前后容器内压强变化(p后/p前)如下表:
时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
p后/p前 | 0.90 | 0.85 | 0.82 | 0.81 | 0.80 | 0.80 |
(5)反应前1小时内的平均反应速率v(H2)为______mol/(L·h),该温度下CO2的平衡转化率为______。
Ⅳ.电解逆转化制乙醇
(6)科研人员通过反复实验发现:CO2可以在酸性水溶液中电解生成乙醇,则生成乙醇的反应发生在______极(填“阴”或“阳”),该电极的反应式为______。