题目内容
【题目】电解精炼铜的阳极泥中主要含Ag、Au等贵重金属。以下是从精炼铜的阳极泥中回收银、金的流程图:
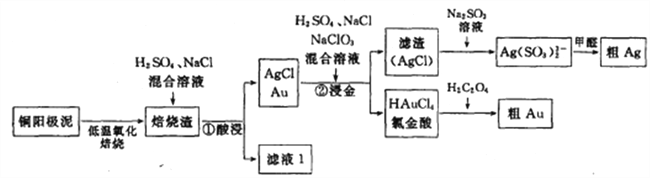
(1)氯金酸(HAuCl4)中的Au的化合价为________
(2)铜阳极泥氧化时,采用“低温焙烧”而不采用“高温焙烧”的原因是________
(3)“焙烧渣”在“①酸浸”时发生反应的离子方程式为_________
(4)“②浸金”反应中,H2SO4的作用为_____,该步骤的分离操作中,需要对所得的AgCl进行水洗。简述如何判断AgCl已经洗涤干净?__________.
(5)氯金酸(HAuCl4)在PH为2~3的条件下被草酸还原为Au,同时放出二氧化碳气体,则该反应的化学方程式为____________
(6)甲醛还原法沉积银,通常是在搅拌下于室温及弱碱性条件下进行,甲醛被氧化为碳酸氢根离子,则该反应的离子方程式为______________电解法精炼银,用10A的电流电解30min,若电解效率(通过一定电量时阴极上实际沉积的金属质量与通过相同电量时理论上应沉积的金属质量之比)为80%,此时可得到银单质的质量为________。(保留1位小数,法拉第常数96500C/mol)
【答案】 +3 高温焙烧时,生成的Ag2O又分解为Ag和O2(或2Ag2O![]() 4Ag+O2) Ag2O + 2H+ +2Cl-
4Ag+O2) Ag2O + 2H+ +2Cl- ![]() 2AgCl+H2O 提供H+ ,增强NaClO3的氧化性 取最后一次洗涤液少许于试管中,滴入Ba(NO3)2溶液,若没有白色沉淀产生,则已经洗涤干净,反之,则需要继续洗涤 2HAuCl4 + 3H2C2O4
2AgCl+H2O 提供H+ ,增强NaClO3的氧化性 取最后一次洗涤液少许于试管中,滴入Ba(NO3)2溶液,若没有白色沉淀产生,则已经洗涤干净,反之,则需要继续洗涤 2HAuCl4 + 3H2C2O4 ![]() 2Au + 8HCl + 6CO2↑ 4Ag(SO3)23- + HCHO + 5OH-
2Au + 8HCl + 6CO2↑ 4Ag(SO3)23- + HCHO + 5OH- ![]() 4Ag + 8SO32- + 3H2O+ HCO3- 16.1 g
4Ag + 8SO32- + 3H2O+ HCO3- 16.1 g
【解析】(1)根据化合价法则,氢为+1价,氯为-1价,所以金为+3价;正确答案:+3。
(2)阳极泥中有金属银、金等;高温焙烧时,生成的Ag2O又分解为Ag和O2(或2Ag2O![]() 4Ag+O2);正确答案:高温焙烧时,生成的Ag2O又分解为Ag和O2(或2Ag2O
4Ag+O2);正确答案:高温焙烧时,生成的Ag2O又分解为Ag和O2(或2Ag2O![]() 4Ag+O2)。
4Ag+O2)。
(3)“焙烧渣”中的主要成分为氧化银、金等;所以加入酸后,氧化银与酸反应,金不反应;在“①酸浸”时发生反应的离子方程式为Ag2O + 2H+ +2Cl- ![]() 2AgCl+H2O;正确答案:Ag2O + 2H+ +2Cl-
2AgCl+H2O;正确答案:Ag2O + 2H+ +2Cl- ![]() 2AgCl+H2O。
2AgCl+H2O。
4)“②浸金”反应中,H2SO4的作用为提供氢离子,增强NaClO3的氧化性; 主要检验洗涤液中是否含有硫酸根离子,试剂用盐酸和硝酸钡溶液;具体操作为取最后一次洗涤液少许于试管中,滴入Ba(NO3)2溶液,若没有白色沉淀产生,则已经洗涤干净,反之,则需要继续洗涤。正确答案:提供H+ ,增强NaClO3的氧化性; 取最后一次洗涤液少许于试管中,滴入Ba(NO3)2溶液,若没有白色沉淀产生,则已经洗涤干净,反之,则需要继续洗涤。
(5)氯金酸(HAuCl4)在PH为2~3的条件下被草酸还原为Au,同时放出二氧化碳气体,则该反应的化学方程式为2HAuCl4 + 3H2C2O4 ![]() 2Au + 8HCl + 6CO2↑ ;正确答案:2HAuCl4 + 3H2C2O4
2Au + 8HCl + 6CO2↑ ;正确答案:2HAuCl4 + 3H2C2O4 ![]() 2Au + 8HCl + 6CO2↑。
2Au + 8HCl + 6CO2↑。
(6)根据流程可知Ag(SO3)23- 被甲醛还原为银,而甲醛被氧化为碳酸氢根离子,该反应的离子方程式为4Ag(SO3)23- + HCHO + 5OH- ![]() 4Ag + 8SO32- + 3H2O+ HCO3-;根据计算公式:转移电子的物质的量为(10×30×60)÷(1.6×10-19)÷(6.02×10-23)=0.187mol,根据极反应:Ag++e-=Ag,可知生成单质银的量为0.187mol×80%=0.15 mol,生成银的质量0.15×108=16.1 g;正确答案:16.1 g。
4Ag + 8SO32- + 3H2O+ HCO3-;根据计算公式:转移电子的物质的量为(10×30×60)÷(1.6×10-19)÷(6.02×10-23)=0.187mol,根据极反应:Ag++e-=Ag,可知生成单质银的量为0.187mol×80%=0.15 mol,生成银的质量0.15×108=16.1 g;正确答案:16.1 g。