题目内容
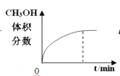
【题目】氮化镓(![]() )材料具有低的热产生率和高的击穿电场,是制造大功率和高频微波电子器件的理想半导体材料。
)材料具有低的热产生率和高的击穿电场,是制造大功率和高频微波电子器件的理想半导体材料。
已知:①Ga和Al同主族且相邻,化学性质与铝相似;②在室温下,氮化镓不溶于水,硬度高,熔点高,能与热的碱溶液缓慢反应。
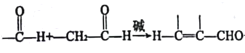
(1)配平氮化镓制备的化学方程式:□Ga(l)+□NH3(g)□GaN(s)+□H2(g)+QkJ(Q>0)_____________
(2)上述反应的平衡常数表达式K=_____________;在恒温恒容密闭容器中制备氮化镓,下列有关说法正确的是_____________
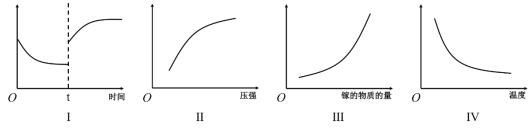
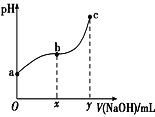
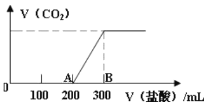
A.Ⅰ图像中如果纵坐标为正反应速率,则t时刻改变的条件可能是加压
B.Ⅱ图像中纵坐标可以为镓的转化率
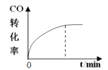
C.Ⅲ图像中纵坐标可以为化学反应速率
D.Ⅳ图像中纵坐标可以为平衡常数
(3)Ga最外层电子的核外电子排布式___________________,N核外能量最高的电子亚层上电子云空间伸展方向有_____________种;
(4)氮化镓的晶体类型_____________,氮化铝和氮化镓晶体类型相同,且结构相似,比较两者熔点的高低并解释原因_____________________________________________________________;
(5)写出氮化镓溶于热的NaOH溶液的离子方程式____________________________________。
【答案】2223 K= AD 4s24p1 3 原子晶体 熔点AlN>GaN,晶体类型相同,结构相似,原子半径Al<Ga,氮铝键比氮镓键更稳定,所以AlN熔点更高 GaN+OH-+H2O
AD 4s24p1 3 原子晶体 熔点AlN>GaN,晶体类型相同,结构相似,原子半径Al<Ga,氮铝键比氮镓键更稳定,所以AlN熔点更高 GaN+OH-+H2O![]() GaO2-+NH3↑
GaO2-+NH3↑
【解析】
(1)根据氧化还原反应规律配平氮化镓制备的化学方程式;
(2)根据平衡常数的定义书写表达式;结合外界条件变化对平衡体系的影响分析判断图像;
(3)Ga为31号元素,根据构造理论书写核外电子排布式,进而判断最外层电子排布式;根据N的核外电子排布式分析判断电子的伸展方向;
(4)氮化镓不溶于水,硬度高,熔点高,据此分析晶体类型;晶体类型相同,结构相似,原子半径Al<Ga,结合键能大小分析判断;
(5)根据已知信息提供的Ga化学性质,能与热的碱溶液缓慢反应,类比Al的性质,氮化镓与热的NaOH溶液反应生成NaGaO2和NH3,据此书写方程式。
(1)Ga元素由0价变为+3价,H元素由+1价变为0价,根据氧化还原反应电子得失守恒,配平氮化镓制备的化学方程式为:2Ga(l)+2NH3(g)2GaN(s)+3H2(g);
(2)平衡常数的定义为平衡时生成物浓度的计量系数次幂的乘积与反应物浓度计量系数次幂的乘积的比值;注意纯液体和固体没有浓度变化量,不写入平衡常数表达式,则根据反应2Ga(l)+2NH3(g) 2GaN(s)+3H2(g),平衡常数的表达式K= ;
;
结合外界条件变化对平衡体系的影响
A.则t时刻改变的条件可能是加压,增大压强,反应率加快,反应逆向移动,逆反应速率大于正反应速率,与Ⅰ图像相符,故A正确;
B.增大压强,反应率加快,反应逆向移动,镓的含量增大,转化率降低,与Ⅱ图像不符,故B错误;
C.镓在反应体系中为纯液体,没有浓度变化量,增大镓的量,没有浓度变化,反应速率不变,与Ⅲ图像不符,故C错误;
D.平衡常数常数只受温度影响,2Ga(l)+2NH3(g)2GaN(s)+3H2(g)+QkJ(Q>0),则正反应放热,升高温度,反应逆向移动,平衡常数减小,与Ⅳ图像相符,故D正确;
答案选AD;
(3)Ga为31号元素,根据构造理论,基态原子核外电子排布式为1s2 2s22p63s23p63d104s24p1 (或[Ar]3d104s24p1),最外层电子的核外电子排布式为4s24p1;基态N原子核外电子排布式为1s2 2s22p3,能量最高的电子亚层为2p,p能级上有三个轨道,电子云空间伸展方向有3种;
(4)氮化镓不溶于水,硬度高,熔点高,为原子晶体;晶体类型相同,结构相似,原子半径Al<Ga,氮铝键比氮镓键更稳定,所以AlN熔点更高,则熔点:AlN>GaN;
(5)根据已知信息提供的Ga化学性质,能与热的碱溶液缓慢反应,类比Al的性质,氮化镓与热的NaOH溶液反应生成NaGaO2和NH3,化学反应方程式为:GaN+OH-+H2O![]() GaO2-+NH3↑。
GaO2-+NH3↑。

【题目】“花卉保鲜剂”是一种可以延长花期的试剂。如表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(gmol1) |
蔗糖 | 25.00 | 342 |
硫酸钾 | 0.87 | 174 |
阿司匹林 | 0.17 | 180 |
高锰酸钾 | 0.316 | 158 |
硝酸银 | 0.0075 | 170 |
(1)下列“花卉保鲜剂”的成分中,属于非电解质的是______,可做杀菌剂的是____
A. 高锰酸钾B. 硫酸钾C. 蔗糖D. 硝酸银E. 水
(2) 配制1L上述“鲜花保鲜剂”需要高锰酸钾______mol。
(3)在溶液配制过程中,下列操作会使配制结果无影响的是______。
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚配制完一定物质的量浓度的氯化钠溶液未洗涤
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(4)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为______mol/L。
(5)如果用高铁酸钾(K2FeO4)代替高锰酸钾效果会更好,湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O.碱性条件下,氧化剂与还原剂的物质的量的比为3:2发生反应,写出并配平湿法制备高铁酸钾的离子反应方程式___________________________________________________________