��Ŀ����
����Ŀ��������ȼ�ϵ�ؽ�����ͼʵ�飨ͼ�����õ缫��Ϊ���Ե缫)��
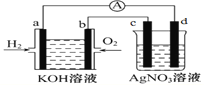
��1���缫aΪ______��������������������������Һ��OH-����______��������a������b������
��2���缫b���������ĵ缫��Ӧ����ʽΪ___________________��
��3�����ŷ�Ӧ�Ľ��У�����ȼ�ϵ���ڲ���pH��______������������������С������
��4��c��Ϊ________�������������������������缫��ӦʽΪ_____________________��
��5���ұ�װ����ʢ�������� AgNO3��Һ��������ȼ�ϵ������������1.12L����״���£�ʱ�����ʱ�ұ�װ����________�缫��������_________g��
��6��������ͼ�е��������ɼ״�����ȼ�ϵ�ظ����缫��ӦʽΪ___________________��
���𰸡� �� a O2 + 2H2O + 4e- = 4OH- ��С ���� 4OH- - 4e- = O2�� + 2H2O d 10.8 CH3OH��6e��+8OH��===CO32��+6H2O
��������������������⿼���ش���װ�õķ�����ȼ�ϵ�صĹ���ԭ������ش���װ�õļ��㡣
��1������ȼ�ϵ���У�ͨ��H2�ĵ缫aΪ������ͨ��O2�ĵ缫bΪ��������Һ��OH-����������a����
��2���缫b��ΪO2�����õ��ӵĻ�ԭ��Ӧ�����Ե������Һ�У��缫��ӦʽΪ��O2+4e-+2H2O=4OH-��
��3������ȼ�ϵ�صĵ�ط�Ӧ����ʽΪ��2H2+O2=2H2O����Һ��H2O���ӣ�KOH��Ũ�ȼ�С������ڲ���pH��С��
��4��c��ȼ�ϵ�ص�����b������c��Ϊ������OH-�ķŵ���������NO3-��c���ĵ缫��ӦʽΪ��4OH--4e-=O2��+2H2O��
��5�����������AgNO3��Һ�������������ӣ���ͼ֪d��ȼ�ϵ�صĸ���a������d��Ϊ������d������������n��H2��=1.12L![]() 22.4L/mol=0.05mol�����ݵ缫��Ӧʽ��H2-2e-+2OH-=2H2O�����·��ͨ���������ʵ���Ϊ0.1mol�����ݵ缫��Ӧʽ��Ag++e-=Ag��d��������Ag�����ʵ���Ϊ0.1mol��d����������0.1mol
22.4L/mol=0.05mol�����ݵ缫��Ӧʽ��H2-2e-+2OH-=2H2O�����·��ͨ���������ʵ���Ϊ0.1mol�����ݵ缫��Ӧʽ��Ag++e-=Ag��d��������Ag�����ʵ���Ϊ0.1mol��d����������0.1mol![]() 108g/mol=10.8g��
108g/mol=10.8g��
��6������H2����CH3OH���ڼ���������CH3OH��������CO32-��1molCH3OHʧȥ6mol�����������ĵ缫��ӦʽΪ��CH3OH-6e-+8OH-=CO32-+6H2O��

����Ŀ�������й�ʵ���������ʵ������ȷ����(����)��
ѡ�� | ʵ���������ʵ | ���� |
A | �������Һ��S | �ȵ���������ų�Ag+��C |
B | �Ʊ���������ʱ,����Ӧ�����Թ�������Na2CO3��Һ��Һ���Ϸ� | ��������������̼������Һ,��ֹ�������� |
C | ��Fe(NO3)2��Һ�м���ϡ����,�Թܿ��к���ɫ������� | ��Һ��N |
D | ��Mg(HCO3)2��Ӳˮ��ʱ���ּ���,���յõ��ij��������Ҫ�ɷ�ΪMg(OH)2,������MgCO3 | Ksp(MgCO3)<Ksp[Mg(OH)2] |
A. A B. B C. C D. D
����Ŀ��ҳ�����Ǵ�ҳ�Ҳ��п��ɵ�һ�ַdz���Ҫ����Ȼ����Դ,ҳ��������Ҫ�ɷ��Ǽ���,�ǹ��ϵĽྻ��Դ��
��1��ҳ��������������ȼ��,�������������ϳ���(CO��H2)��CH4��H2O(g)ͨ��۽�̫���ܷ�Ӧ��,������ӦCH4(g)+H2O(g) = CO(g)+3H2(g)����H1����֪:CH4��H2��CO��ȼ����(��H)�ֱ�Ϊ-a kJ��mol-1��-b kJ��mol-1��-c kJ��mol-1;H2O(l)=H2O(g)����H=+d kJ��mol-1��
����H1=______________(�ú���ĸa��b��c��d�Ĵ���ʽ��ʾ)kJ��mol-1��
��2���úϳ������ɼ״��ķ�ӦΪCO(g)+2H2(g)![]() CH3OH(g)����H2,��10 L�����ܱ������а����ʵ���֮��1��2����CO��H2,���CO��ƽ��ת�������¶Ⱥ�ѹǿ�Ĺ�ϵ��ͼ��ʾ:
CH3OH(g)����H2,��10 L�����ܱ������а����ʵ���֮��1��2����CO��H2,���CO��ƽ��ת�������¶Ⱥ�ѹǿ�Ĺ�ϵ��ͼ��ʾ:

200 ��ʱn(H2)��ʱ��ı仯���±���ʾ:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
�٦�H2____(����>����<������=��)0��
��д��������ͬʱ��߷�Ӧ���ʺ�COת���ʵĴ�ʩ:_____��
������˵����ȷ����____(����ĸ)��
a.�¶�Խ��,�÷�Ӧ��ƽ�ⳣ��Խ��
b.��ƽ����ٳ���ϡ������,CO��ת�������
c.����������ѹǿ���ٱ仯ʱ,��Ӧ�ﵽ�����
d.ͼ��ѹǿ:p1<p2
��0~3 min����CH3OH��ʾ�ķ�Ӧ����v(CH3OH)=____mol��L-1��min-1��
��200 ��ʱ,�÷�Ӧ��ƽ�ⳣ��K=____��������200 ���ﵽƽ��ĺ����ܱ��������ټ���2 mol CO��4 mol H2��2 mol CH3OH,�����¶Ȳ���,��ѧƽ��____(��������������������������)�ƶ���
��3�����顢������KOH��Һ�����ȼ�ϵ�ء���״���³���5.6 L����,��õ�·��ת��1.2 mol����,������������Ϊ____��