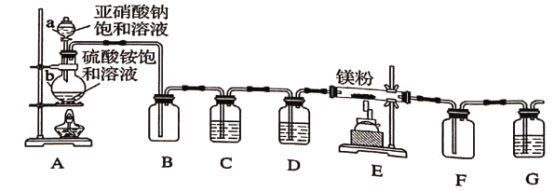
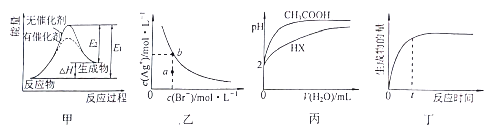
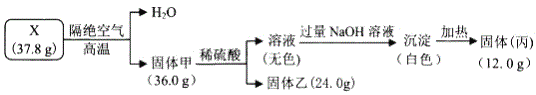
��Ŀ����
����Ŀ��ʹ��Ӧ4NH3(g)+3O2(g)=2N2(g)+6H2O(g)��2L���ܱ������н��У�����Ӻ�N2�����ʵ���������0.6mol���˷�Ӧ��ƽ��������(X��Ϊ
A.��(NH3)�T0.04mol��L��1��s��1B.��(O2)�T0.015mol��L��1��s��1
C.��(N2)�T0.02mol��L��1��s��1D.��(H2O)�T0.02mol��L��1��s��1
���𰸡�B
��������
����![]() ���㷴Ӧ���ʣ���n=0.6mol����t=30s��V=2L����
���㷴Ӧ���ʣ���n=0.6mol����t=30s��V=2L����![]() ����ͬһ����ѧ��Ӧ�У��ò�ͬ�����ʱ�ʾ��ѧ��Ӧ��������ֵ֮�ȵ��ڼ�����֮�ȡ�
����ͬһ����ѧ��Ӧ�У��ò�ͬ�����ʱ�ʾ��ѧ��Ӧ��������ֵ֮�ȵ��ڼ�����֮�ȡ�
A��v(NH3): v(N2)=4:2����v(NH3)=2v(N2)= 2��0.01mol��L��1��s��1=0.02mol��L��1��s��1��A����
B��v(O2): v(N2)=3:2����v(O2)=![]() v(N2)=
v(N2)= ![]() ��0.01mol��L��1��s��1=0.015mol��L��1��s��1��B��ȷ��
��0.01mol��L��1��s��1=0.015mol��L��1��s��1��B��ȷ��
C��v(N2)= 0.01mol��L��1��s��1��C����
D��v(H2O): v(N2)=6:2����v(NH3)=3v(N2)= 3��0.01mol��L��1��s��1=0.03mol��L��1��s��1��D����
��ѡB��

��ϰ��ϵ�д�
 ��˼ά������ҵ��ټ��ִ�ѧ������ϵ�д�
��˼ά������ҵ��ټ��ִ�ѧ������ϵ�д�
�����Ŀ