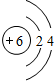题目内容
A 元素的原子最外层电子数是a,次外层电子数是b,B 元素的原子 M 层电子数是(a-b),L 层电子数是(a+b),则 A、B 两种元素形成的化合物的化学式和形成晶体的类型可能为( )
分析:原子的核外电子排布规律是:先排K层,再排L层和M层,二氧化硅是由硅原子和氧原子构成的原子晶体.
解答:解:A如果是第三周期的话,次外层电子数b等于8,那么B元素的L层电子数将超过8,矛盾,所以A是第二周期元素,b=2;由B元素L层电子数为a+b,而L层应该是B元素的次外层,所以a=6,这样,A是氧,B是硅,A和B形成的是二氧化硅,属于原子晶体.
故选B.
故选B.
点评:本题是一道有关原子结构的推断题,考查了原子核外电子的排布规律以及分子的晶体类型方面的知识.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目