题目内容
【题目】(1)写出下列微粒的电子式:NaOH__________;CS2_________;Na2S_________NH3__________;NH4H________;
(2)用电子式表示下列物质的形成过程MgCl2______________________
(3)现有下列物质:①Cl2 ②Na2O2 ③NaOH ④HCl ⑤H2O2 ⑥MgF2 ⑦NH4Cl①只由离子键构成的物质是________________。
②只由极性键构成的物质是_______________。
③由极性键和非极性键构成的物质是________________。
④由离子键和极性键构成的物质是________________。
⑤由离子键和非极性键构成的物质是________________。
【答案】![]()
![]()
![]()
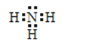
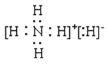
![]() ⑥ ④ ⑤ ③⑦ ②
⑥ ④ ⑤ ③⑦ ②
【解析】
本题考查的是离子化合物的结构特征与性质、共价键的形成及共价键的主要类型、 极性键和非极性键。活泼金属和活泼非金属元素之间易形成离子键,同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物,据此分析解答。
(1)NaOH中钠离子与氢氧根离子通过离子键结合,氢氧根离子中的氢原子和氧原子通过共价键结合,电子式为![]() ;CS2中的硫原子和氧原子通过共用电子对相结合共形成了四对共用电子对,电子式为
;CS2中的硫原子和氧原子通过共用电子对相结合共形成了四对共用电子对,电子式为![]() ;Na2S中的钠离子和硫离子通过离子键结合,电子式为
;Na2S中的钠离子和硫离子通过离子键结合,电子式为![]() ;NH3中的氮原子和氢原子通过共用电子对结合共形成了三对共用电子对,电子式为
;NH3中的氮原子和氢原子通过共用电子对结合共形成了三对共用电子对,电子式为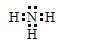 ;NH4H中的铵根离子和H-通过离子键相结合,铵根离子中的氮原子和氢原子通过共价键相结合,电子式为
;NH4H中的铵根离子和H-通过离子键相结合,铵根离子中的氮原子和氢原子通过共价键相结合,电子式为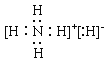 。本小题答案为:
。本小题答案为:![]() ;
;![]() ;
;![]() ;
;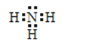 ;
;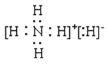 。
。
(2)MgCl2中的镁离子和氯离子通过离子键相结合,形成过程为![]() 。本小题答案为:
。本小题答案为:![]() 。
。
(3)①Cl2中ClCl原子之间只存在非极性键,为单质;②Na2O2中钠离子和过氧根离子之间存在离子键、OO原子之间存在非极性键,为离子化合物;③NaOH中钠离子和氢氧根离子之间存在离子键、OH原子之间存在极性键,为离子化合物;④HCl分子中HCl原子之间只存在极性键,为共价化合物;⑤H2O2中HO之间存在极性键、OO原子之间存在非极性键,为共价化合物;⑥MgF2中镁离子和氟离子之间只存在离子键,为离子化合物;⑦NH4Cl中铵根离子和氯离子之间存在离子键、NH原子之间存在极性共价键,为离子化合物;
①通过以上分析知,只含离子键的是⑥。本小题答案为⑥。
②只有极性键构成的物质是④。本小题答案为④。
③由极性键和非极性键构成的物质是⑤。本小题答案为⑤。
④由离子键和极性键构成的物质是③⑦,本小题答案为③⑦。
⑤由离子键和非极性键构成的物质是②,本小题答案为②。

 名校课堂系列答案
名校课堂系列答案