题目内容
(1)下面是某研究性学习小组对蜡烛及其燃烧的探究报告,请你完成该实验报告:探究步骤 | 实验现象 | 结论或产生这一现象的原因 |
①将一小块蜡烛放入水中 |
| 结论: |
②燃着时 | 有明亮火焰 | — |
③刚吹灭时 |
| 原因: |
(2)有两瓶失去标签的物质的量浓度为1 mol·L-1的碳酸钠和1 mol·L-1的碳酸氢钠溶液,请你加以鉴别:
①下列试剂中,可选用的一种试剂是__________(填代号)。
A.氢氧化钠溶液 B.甲基橙溶液 C.稀盐酸 D.澄清石灰水
②除上述方法外,你认为是否还有较简单的方法。
(1)
探究步骤 | 实验现象 | 结论或产生这一现象的原因 |
| 蜡烛浮在水面上 | 蜡烛不溶于水且密度比水小 |
| — | — |
| 有白烟产生 | 石蜡蒸气冷却变成固体小颗粒 |
(2)①C
②方法一:用pH试纸分别测定两溶液的pH。
方法二:取两种溶液各少许,分别滴加CaCl2溶液加以鉴别。

 考前必练系列答案
考前必练系列答案下面是某学习小组对乙二酸的某些性质进行研究性学习的过程:
【研究课题】探究乙二酸的某些性质
【查阅资料】乙二酸(HOOC-COOH)俗称草酸,其主要物理常数如下:
| 名称 | 乙二酸 | 乙二酸晶体 |
| 分子式 | H2C2O4 | H2C2O4·2H2O |
| 颜色状态 | 无色固体 | 无色晶体 |
| 溶解度(g) | 8.6(20℃) | — |
| 熔点(℃) | 189.5 | 101.5 |
| 密度(g·cm-3) | 1.900 | 1.650 |
 华,157℃时大量升华,并开始分解。草酸钙不溶于水。根据上述材料提供的信息,回答下列问题:
华,157℃时大量升华,并开始分解。草酸钙不溶于水。根据上述材料提供的信息,回答下列问题:【提出猜想】
[猜想一]根据草酸晶体的组成对其分解产物进行猜想
[设计方案]
(1)该小组同学猜想其产物为CO、CO2和H2O,并设计了探究实验,实验装置如下(草酸晶体分解装置略)。
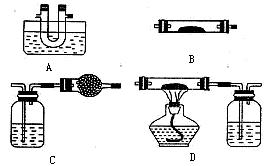
限选试剂:澄清石灰水、冰水混合物、碱石灰、氧化铜、无水硫酸铜(已知草酸蒸气也可使澄清石灰水变浑浊,草酸蒸气在低温下可冷凝为固体)。请回答下列问题:
①B装置中所装药品为 ,
② CO2的检验装置是 (填上面装置编号,下同),CO的检验装置是 。
③装置A的作用是 。
[猜想二]乙二酸具有弱酸性
[设计方案]
(2)该小组同学为验证草酸具有弱酸性设计了下列实验,其中能达到实验目的是 (填字母)。
| A.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色 |
| B.测定相同浓度的草酸和硫酸溶液的pH |
| C.测定草酸钠(Na2C2O4)溶液的pH |
| D.将草酸溶液加入Na2CO3溶液中,有CO2放出 |
[设计方案]
(3)该小组同学向用硫酸酸化的KMnO4溶液中滴入过量的草酸溶液,发现酸性KMnO4溶液褪色,从而判断草酸具有较强的还原性。配平该反应的离子方程式:
MnO4- + H2C2O4 + H+ = Mn2+ + CO2↑+ H2O
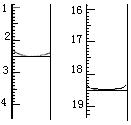
(4)利用上述原理可定量测定某草酸晶体样品中H2C2O4·2H2O的含量,方法是:称取该样品0.12 g,加适量水完全溶解,然后用0.020 mol·L-1的酸性KMnO4溶液滴定至终点(杂质不参与反应),滴定前后滴定管中的液面读数如图所示,则该草酸晶体样品中H2C2O4·2H2O的质量分数为 。
下面是某学习小组对乙二酸的某些性质进行研究性学习的过程:
【研究课题】探究乙二酸的某些性质
【查阅资料】乙二酸(HOOC-COOH)俗称草酸,其主要物理常数如下:
|
名称 |
乙二酸 |
乙二酸晶体 |
|
分子式 |
H2C2O4 |
H2C2O4·2H2O |
|
颜色状态 |
无色固体 |
无色晶体 |
|
溶解度(g) |
8.6(20℃) |
— |
|
熔点(℃) |
189.5 |
101.5 |
|
密度(g·cm-3) |
1.900 |
1.650 |
又知草酸在100℃时开始升华,157℃时大量升华,并开始分解。草酸钙不溶于水。根据上述材料提供的信息,回答下列问题:
【提出猜想】
[猜想一]根据草酸晶体的组成对其分解产物进行猜想
[设计方案]
(1)该小组同学猜想其产物为CO、CO2和H2O,并设计了探究实验,实验装置如下(草酸晶体分解装置略)。

限选试剂:澄清石灰水、冰水混合物、碱石灰、氧化铜、无水硫酸铜(已知草酸蒸气也可使澄清石灰水变浑浊,草酸蒸气在低温下可冷凝为固体)。请回答下列问题:
①B装置中所装药品为 ,
② CO2的检验装置是 (填上面装置编号,下同),CO的检验装置是 。
③装置A的作用是 。
[猜想二]乙二酸具有弱酸性
[设计方案]
(2)该小组同学为验证草酸具有弱酸性设计了下列实验,其中能达到实验目的是 (填字母)。
A.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色
B.测定相同浓度的草酸和硫酸溶液的pH
C.测定草酸钠(Na2C2O4)溶液的pH
D.将草酸溶液加入Na2CO3溶液中,有CO2放出
[猜想三]乙二酸具有还原性
[设计方案]
(3)该小组同学向用硫酸酸化的KMnO4溶液中滴入过量的草酸溶液,发现酸性KMnO4溶液褪色,从而判断草酸具有较强的还原性。配平该反应的离子方程式:
MnO4- + H2C2O4 + H+ = Mn2+ + CO2↑+ H2O
(4)利用上述原理可定量测定某草酸晶体样品中H2C2O4·2H2O的含量,方法是:称取该样品0.12 g,加适量水完全溶解,然后用0.020 mol·L-1的酸性KMnO4溶液滴定至终点(杂质不参与反应),滴定前后滴定管中的液面读数如图所示,则该草酸晶体样品中H2C2O4·2H2O的质量分数为 。


