题目内容
【题目】常温下,氯化亚硝酰(NOCl)足一种红黄色气体,其熔点- 64.5℃,沸点-5.5℃,可被水分解,其一种制备原理为Cl2+2NO =2NOC1。实验装置如下图所示,回答下列问题:
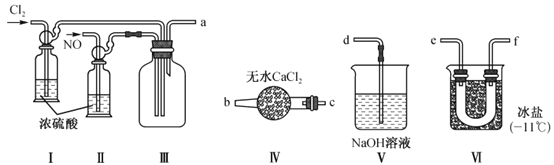
(1)实验前须排尽装置I、Ⅱ、Ⅲ中的空气,其原因是__________________________。
(2)NO是用铜与稀硝酸反应制得,其离子方程式为__________________________。
(3)图中各装置连接顺序为a→________________(按气流自左向右方向,用小写字母表示)。
(4)装置I、Ⅱ的作用是观察气泡调节气体的流速和________________________________。
(5)装置V是为了吸收尾气,防止污染环境,其中吸收NOC1时反应的化学方程式为____________(非氧化还原反应)。
【答案】 NO易与空气中的氧气反应 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O ef(或fe)→cb→d 干燥NO和Cl2 NOCl+2NaOH =NaCl+NaNO2 +H2O
【解析】试题分析:由题中信息和装置图可知,氯气和一氧化氮在III中反应生成NOCl,在VI中被冰盐冷凝为液态,尾气用氢氧化钠溶液吸收,为防止NOCl被水分解,应在III和VI中间连上IV。
(1)实验前须排尽装置I、Ⅱ、Ⅲ中的空气,其原因是NO易与空气中的氧气反应生成NO2。
(2)NO是用铜与稀硝酸反应制得,其离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O 。
(3)图中各装置连接顺序为a→ef(或fe)→cb→d 。
(4)装置I、Ⅱ的作用是观察气泡调节气体的流速(理论上氯气和一氧化氮的流速之比为1:2时,两者能恰好反应)和干燥NO和Cl2 。
(5)装置V是为了吸收尾气,防止污染环境,其中吸收NOC1时反应的化学方程式为NOCl+2NaOH =NaCl+NaNO2 +H2O 。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某学生利用物质间的互变,设计成一个平面魔方,如图所示: 
已知:
①A、B、C、D、G含有同种元素.
②E 是通常情况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀.B具有氧化性,液显黄色,能将SO2氧化为F(H2SO4),F与A反应生成E、G.
③
纯A(单质) | B溶液 | C固体 | D固体 | G溶液 |
颜色 | 银白色(粉末状时为黑色)黄色红 | 褐色 | 红棕色 | 浅绿色 |
依据以上信息填空:
(1)请写出E的电子式 .
(2)D的化学式 .
(3)请写出ABCDG所含的同种元素的原子结构示意图 .
(4)G生成C的过程中所出现的现象为
(5)写出A→B化学方程式:
(6)B→F的离子方程式为 .


