题目内容
【题目】氧化铁和氧化亚铁都能与氢碘酸反应,下列相关叙述中正确的是( )
A. 都有铁盐生成B. 都有亚铁盐生成
C. 都是氧化还原反应D. 反应中都无电子转移
【答案】B
【解析】
A项、氧化铁具有氧化性,与氢碘酸发生氧化还原反应生成碘化亚铁和水,氧化亚铁与氢碘酸发生复分解反应生成碘化亚铁和水,故A错误;
B项、氧化铁具有氧化性,与氢碘酸发生氧化还原反应生成碘化亚铁和水,氧化亚铁与氢碘酸发生复分解反应生成碘化亚铁和水,故B正确;
C项、氧化亚铁与氢碘酸发生复分解反应生成碘化亚铁和水,故C错误;
D项、氧化铁具有氧化性,与氢碘酸发生氧化还原反应生成碘化亚铁和水,故D错误;
故选B。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】根据下列实验或实验操作和现象,所得结论正确的是
实验或实验操作 | 现象 | 实验结论 | |
A | 用大理石和盐酸反应制取CO2气体,立即通入一定浓度的Na2SiO3溶液中 | 出现白色沉淀 | H2CO3的酸性比H2SiO3的酸性强 |
B | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中含有SO42-、SO32-、HSO3-中的一种或几种 |
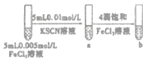
C |
| 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
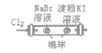
D |
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
A. A B. B C. C D. D