题目内容
 (2012?江苏三模)卤素性质活泼,能形成卤化物、多卤化物等多种类型的化合物.
(2012?江苏三模)卤素性质活泼,能形成卤化物、多卤化物等多种类型的化合物.(1)卤化氢中,HF的沸点高于HCl,原因是
HF分子间形成氢键
HF分子间形成氢键
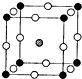
.(2)如图所示为F-与Mg2+、K+形成的某种离子晶体的晶胞,其中“O”表示的离子是
F-
F-
(填离子符号).(3)多卤化物Rb[ICl2]分解时生成晶格能相对较大的铷(Rb)的卤化物,则该卤化物的化学式为
RbCl
RbCl
.(4)BF3与NH3,能发生反应生成X(H3BNF3),X的结构式为
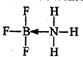
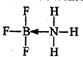
sp3
sp3
.(5)有一类物质的性质与卤素类似,称为“拟卤素”[如(SCN)2、(CN)2等].(CN)2的结构式为N≡C-C≡N,该分子中σ键和π键数目之比为
3:4
3:4
.分析:(1)卤族元素的氢化物形成的晶体是分子晶体,分子晶体的沸点随着相对分子质量的增大而增大,但含有氢键的物质沸点最高;
(2)利用均摊法计算各种离子的个数,再根据化合物中各元素的化合价代数和为0确定“O”表示的离子;
(3)物质的晶格能与离子半径成反比;
(4)提供空轨道的原子和提供孤电子对的原子之间形成配位键,根据价层电子对互斥理论确定其杂化方式;
(5)共价单键是σ键,共价三键中一个是σ键,两个π键.
(2)利用均摊法计算各种离子的个数,再根据化合物中各元素的化合价代数和为0确定“O”表示的离子;
(3)物质的晶格能与离子半径成反比;
(4)提供空轨道的原子和提供孤电子对的原子之间形成配位键,根据价层电子对互斥理论确定其杂化方式;
(5)共价单键是σ键,共价三键中一个是σ键,两个π键.
解答:解:(1)卤族元素氢化物为分子晶体,相对分子质量越大,分子间作用力越强,沸点越高,但
HF分子之间存在氢键,沸点最高,故答案为:HF分子间形成氢键;
(2)该晶胞中“O”的个数=12×
=3,黑色小球=8×
=1,灰色小球的个数是1,根据化合物中各元素化合价的代数和为0知,“O”表示F-,故答案为:F-;
(3)物质的晶格能与离子半径成反比,晶格能越大物质越稳定,氯离子半径小于碘离子半径,所以形成的化合物是RbCl,故答案为:RbCl;
(4)该化合物中,B原子提供空轨道的原子、N原子提供孤电子对,所以B、N原子之间形成配位键,则X的结构式为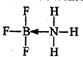 ,BF3?NH3中B原子含有3个σ 键一个配位键,所以其价层电子数是4,B原子采取sp3杂化,
,BF3?NH3中B原子含有3个σ 键一个配位键,所以其价层电子数是4,B原子采取sp3杂化,
故答案为: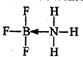 ;sp3;
;sp3;
(5)共价单键是σ键,共价三键中一个是σ键,两个π键,所以N≡C-C≡N中σ键和π键数目之比为3:4,
故答案为:3:4.
HF分子之间存在氢键,沸点最高,故答案为:HF分子间形成氢键;
(2)该晶胞中“O”的个数=12×
| 1 |
| 4 |
| 1 |
| 8 |
(3)物质的晶格能与离子半径成反比,晶格能越大物质越稳定,氯离子半径小于碘离子半径,所以形成的化合物是RbCl,故答案为:RbCl;
(4)该化合物中,B原子提供空轨道的原子、N原子提供孤电子对,所以B、N原子之间形成配位键,则X的结构式为
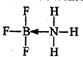 ,BF3?NH3中B原子含有3个σ 键一个配位键,所以其价层电子数是4,B原子采取sp3杂化,
,BF3?NH3中B原子含有3个σ 键一个配位键,所以其价层电子数是4,B原子采取sp3杂化,故答案为:
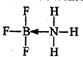 ;sp3;
;sp3;(5)共价单键是σ键,共价三键中一个是σ键,两个π键,所以N≡C-C≡N中σ键和π键数目之比为3:4,
故答案为:3:4.
点评:本题考查物质结构,涉及杂化方式的判断、化学键、晶格能、晶胞的计算等知识点,氢键、杂化方式的判断、晶胞的计算等都是高考的热点,应注意这些方面知识的积累.

练习册系列答案
相关题目