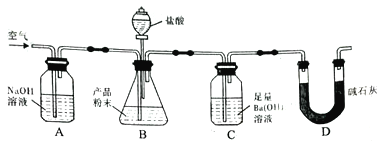
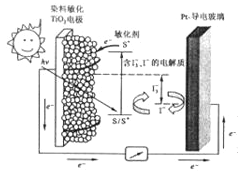
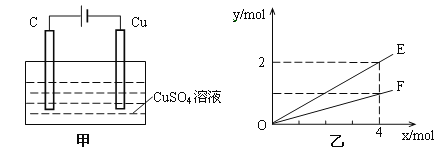
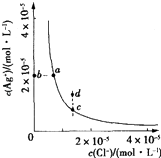
��Ŀ����
����Ŀ���������и�ͼ�����������ȷ���ǣ������� 
A����ͼ��ʾH2��O2������Ӧ�����е������仯����H2��ȼ����Ϊ483.6kJmol��1
B����ͼ��ʾ���º��������·����Ŀ��淴Ӧ2NO2��g��N2O4��g���У������ʵ�Ũ��������������֮��Ĺ�ϵ�����н���A��Ӧ��״̬Ϊ��ѧƽ��״̬
C����ͼ��ʾ
A.B�����ʵ��ܽ�����¶ȱ仯�������A��B������Һ�ֱ���t1��������t2��ʱ�����ʵ�����������ΪA%=B%D����ͼ��ʾ�����£�ϡ��HA��HB�������ϡ��Һʱ����Һ��pH���ˮ���ı仯����ͬŨ�ȵ�NaA��Һ��pH����NaB��Һ
���𰸡�C
���������⣺A��1mol��ȼ����ȫȼ�������ȶ�������ų���������ͼ�з�����֪�ʱ���2mol����ȼ��������̬ˮ�ų���������������ȼ���ȸ����A����
B���ұ�ʾ���º��������·����Ŀ��淴Ӧ2NO2��g��N2O4��g���У������ʵ�Ũ��������������֮��Ĺ�ϵ�����������ұ�ʾŨ���������������ϱ�ʾ�����������ʿ죬����ﵽƽ��״̬���������������֮�ȵ��ڻ�ѧ������֮�ȼ�Ӧ�õ���2��1����B����
C����A��B������Һ�ֱ���t1��������t2��ʱ��Һ�����ʺ��ܼ�����������ı䣬������t1���ܽ����ͬ��������������ͬ������t2��ʱ���ʵ�����������ΪA%=B%����C��ȷ��
D�������£�ϡ��HA��HB�������ϡ��Һʱ����Һ��pH���ˮ���ı仯��֪���ԣ�HA��HB����NaB��Һ��Bˮ��̶ȴ���OH��Ũ�ȴ���Һ��pH��D����
��ѡC��
�����㾫����������Ŀ����֪���������û�ѧƽ��״̬���ʼ����������֪ʶ���Եõ�����Ĵ𰸣���Ҫ���ջ�ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч����