题目内容
【题目】某课外小组研究铝土矿中Al2O3的含量。查阅资料得知,铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
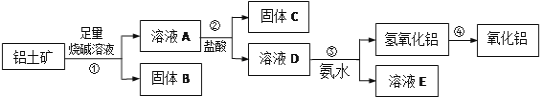
(1)固体B的颜色为_____;
(2)第①步,向铝土矿中加入足量烧碱溶液,充分反应,发生反应的离子方程式是:___、____
(3)第③步中,生成氢氧化铝的离子方程式是______,若往A溶液中通入足量CO2,产生的沉淀为______(填化学式);
(4)工业上制取AlCl3常用Al2O3与C、Cl2在高温条件下反应,已知每消耗0.5mol碳单质,转移1mol电子,则该反应的氧化产物为_____(填化学式)。
【答案】红棕色 Al2O3+2OH-+3H2O=2[Al(OH)4]- SiO2+2OH-=SiO32-+H2O Al3++3NH3H2O=Al(OH)3↓+3NH4+ Al(OH)3、H2SiO3 CO
【解析】
向铝土矿中加入足量烧碱溶液后,氧化铝是两性氧化物,既溶于强酸又溶于强碱。只有Fe2O3只溶于强酸,不溶于碱,SiO2只溶于强碱,不溶于盐酸。则在①得到滤液中含有偏铝酸根离子、硅酸根离子,加入过量的盐酸后生成硅酸和氯化铝,氯化铝溶液中滴入氨水生成氢氧化铝,氢氧化铝受热分解,生成氧化铝,由此分析解答。
(1)根据以上分析固体B为Fe2O3,Fe2O3颜色为红棕色,
因此,本题正确答案是:红棕色;
(2)根据框图流程,向铝土矿中加入足量烧碱溶液后,氧化铝是两性氧化物,既溶液强酸又溶于强碱。Fe2O3只溶于强酸,不溶于碱,SiO2只溶于强碱,不溶于盐酸,则在①得到滤液中含有偏铝酸根离子、硅酸根离子,滤渣为氧化铁氧化铁和氢氧化钠溶液不反应,则向铝土矿中加入足量烧碱溶液后,发生反应的离子方程式是Al2O3+2OH-+3H2O=2[Al(OH)4]-、SiO2+2OH-=SiO32-+H2O,
因此,本题正确答案是:Al2O3+2OH-+3H2O=2[Al(OH)4]-;SiO2+2OH-=SiO32-+H2O;
(3)试剂③为氨水,将铝离子转化为氢氧化铝沉淀.离子方程式为:Al3++3NH3H2O=Al(OH)3↓+3NH4+;若往A溶液中通入足量CO2,硅酸根离子和偏铝酸根离子反应生成硅酸和氢氧化铝,
因此,本题正确答案是:Al3++3NH3H2O=Al(OH)3↓+3NH4+ ;Al(OH)3、H2SiO3 ;
(4)Cl2有强氧化性,碳具有还原性,每消耗0.5mol碳单质,转移1mol电子,这说明反应中碳失去2个电子,即氧化产物是CO,
因此,本题正确答案是:CO。

 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案【题目】下列各组物质中,存在X→Y或Y→Z不能通过一步反应完成转化的一组是
选项 | X | Y | Z |
A | Al | NaAlO2(aq) | Al(OH)3 |
B | MgO | MgCl2(aq) | Mg |
C | H2O(g) | Fe3O4 | Fe |
D | NaOH(aq) | Na2CO3(aq) | NaHCO3(aq) |
A. A B. B C. C D. D
【题目】某研究性学习小组对钠在CO2气体中燃烧进行了下列实验:
操作过程 | 实验现象 |
将干燥纯净的CO2缓缓通过放有钠的干燥玻璃管(已排尽空气)中,加热 | 钠燃烧,火焰为黄色 |
反应后冷却 | 管壁附有黑色颗粒和白色物质 |
(1)若钠着火,可以选用的灭火物质是__________。
A.水 B.泡沫灭火剂 C.干沙土 D.二氧化碳
(2)该小组同学对管壁的白色物质的成分进行讨论并提出假设:
Ⅰ.白色物质可能是Na2O; Ⅱ.白色物质可能是Na2CO3; Ⅲ.白色物质还可能是__________
(3)为确定该白色物质的成分,该小组进行了如下实验:
实验步骤 | 实验现象 |
①少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加过量的CaC12溶液 | 出现白色沉淀 |
②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
①通过对上述实验的分析,你认为上述三个假设中,__________成立。
②该白色物质的水溶液pH>7,用离子方程式表示其原因:___________________。
③钠在CO2中燃烧的化学方程式为______;每生成1mol氧化产物,转移的电子数目为_________。



