题目内容
4.雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生.根据题意完成下列填空:(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体.若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为1:1.
(2)上述反应中的氧化剂是As2S3,反应产生的气体可用氢氧化钠溶液或硫酸铜溶液吸收.
(3)As2S3和HNO3有如下反应:As2S3+H++NO3---H3AsO4+S+NO2↑+H2O
若生成2mol H3AsO4,则反应中转移电子的物质的量为10mol.若将该反应设计成一原电池,则NO2应该在正极(填“正极”或“负极”)附近逸出.
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量a(选填编号).
a.小于0.5mol b.等于0.5mol c.大于0.5mol d.无法确定.
分析 (1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体,反应的方程式为:2As2S3+2SnCl2+4HCl=As4S4+2SnCl4+2H2S↑;
(2)所含氧化化合价降低的反应物为氧化剂;H2S为酸性气体,可用碱溶液吸收,硫化铜不溶于酸,也可以硫酸铜溶液吸收;
(3)反应As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O中,As元素化合价由+3价升高到+5价,S元素化合价由-2价升高到0价,N元素化合价由+5降低为+4,反应中NO3-发生还原反应生成NO2,原电池正极发生还原反应;
(4)若反应得到硝酸能与碳完全反应,纵观整个过程,氧气获得电子等于碳失去电子,根据电子转移守恒计算反应碳的物质的量,但随着反应到进行,硝酸的浓度会降低而稀硝酸不与碳反应.
解答 解:(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体,反应的方程式为:2As2S3+2SnCl2+4HCl=As4S4+2SnCl4+2H2S↑,As2S3和SnCl2的物质的量之比为1:1,
故答案为:1:1;
(2)因在该反应中As2S3中As元素的化合价降低,则As2S3为氧化剂,H2S为酸性气体,可用NaOH溶液吸收,硫化铜不溶于酸,也可以硫酸铜溶液吸收
故答案为:As2S3;氢氧化钠溶液或硫酸铜溶液;
(3)反应As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O中,As元素化合价由+3价升高到+5价,S元素化合价由-2价升高到0价,若生成2mol H3AsO4,转移电子数为2mol×(5-3)+3mol×(0+2)=10mol,
N元素化合价由+5降低为+4,反应中NO3-发生还原反应生成NO2,则NO2在正极析出,
故答案为:10mol;正极;
(4)由NO2与11.2LO2混合后用水吸收全部转化成浓HNO3,浓硝酸与碳反应生成二氧化碳与二氧化氮,若反应得到硝酸能与碳完全反应,纵观整个过程,氧气获得电子等于碳失去电子,氧气的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,根据电子转移守恒,反应碳的物质的量为$\frac{0.5mol×4}{4}$=0.5mol,但随着反应到进行,硝酸的浓度会降低,而稀硝酸不与碳反应,则产生的CO2的量小于0.5mol,
故答案为:a.
点评 本题考查综合氧化还原反应有关问题,侧重于学生的分析能力和计算能力的考查,有利于培养学生的化学科学素养,注意从元素化合价的角度识别相关概念、判断物质的性质.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案| A. | Y和Z可能都是气体 | B. | Y和Z可能都是固体 | ||
| C. | 若Z为固体,则Y一定是气体 | D. | Y和Z一定是气体 |
| A. | 明矾净水 | |
| B. | 卤水点豆腐 | |
| C. | 三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀 | |
| D. | 阳光透过茂密的树林所产生的美丽光线 |
 燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.
燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.(1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物:
①CH4 (g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-570kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
则CH4 (g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-865 kJ•mol-1.
(2)将燃煤废气中的CO2转化为甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g)
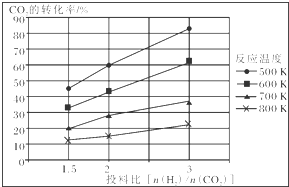
已知在压强为a MPa下,该反应在不同温度、不同投料比时,CO2的转化率见如图:
①此反应为放热(填“放热”、“吸热”);若温度不变,提高投料比[$\frac{n({H}_{2})}{n(C{O}_{2})}$],则K将不变(填“增大”、“减小”或“不变”).
②在a MPa和一定温度下,将6mol H2和2mol CO2在2L密闭容器中混合,当该反应达到平衡时,测得平衡混合气中CH3OCH3的体积分数约为16.7%(即$\frac{1}{6}$),此时CO2的转化率为80%
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实 验 组 | 温 度 /℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是b=2a,a>1(用含a、b的数学式表示).
| A. | 碳酸钙溶于稀盐酸中:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 铁和稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 碳酸氢钠溶液中滴入NaOH溶液:HCO${\;}_{3}^{-}$+OH-═H2O+CO2↑ | |
| D. | 硫酸溶液中加入氢氧化钡溶液:Ba2++SO${\;}_{4}^{2-}$═BaSO4↓ |
| A. | 氮化硅、氧化铝陶瓷和光导纤维都是无机非金属材料 | |
| B. | 绚丽缤纷的烟花中添加了含钾、钠、钙、铜等金属元素的化合物 | |
| C. | “海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化 | |
| D. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 |
 .
.
 ,DMCCH3OCOOCH3.
,DMCCH3OCOOCH3.