题目内容
用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O,工艺流程如下(部分操作和条件略):
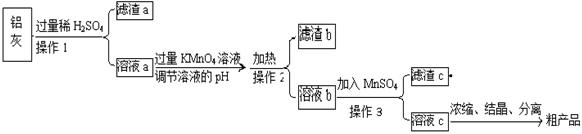
(1)滤渣a可用于制造
(2)请将MnO4-氧化Fe2+的离子方程式补充完整:
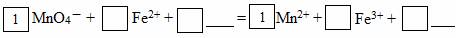
若反应中转移了2mol电子,则消耗氧化剂的物质的量为 mol。
(3)已知生成氢氧化物沉淀的pH如下:
调节溶液pH约为3的目的是: 。
(4)取少量滤渣C于试管中,加入适量的双氧水,产生能使带火星小木条复燃的气体,说明滤渣C的主要成分是 。请写出加入MnSO4时所发生反应的离子方程式: 。
(5)A12(SO4)3·18H2O溶于水溶液呈酸性的原因: 。(用离子方程式表示)

(1)滤渣a可用于制造
(2)请将MnO4-氧化Fe2+的离子方程式补充完整:
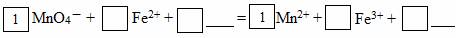
若反应中转移了2mol电子,则消耗氧化剂的物质的量为 mol。
(3)已知生成氢氧化物沉淀的pH如下:
| | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
调节溶液pH约为3的目的是: 。
(4)取少量滤渣C于试管中,加入适量的双氧水,产生能使带火星小木条复燃的气体,说明滤渣C的主要成分是 。请写出加入MnSO4时所发生反应的离子方程式: 。
(5)A12(SO4)3·18H2O溶于水溶液呈酸性的原因: 。(用离子方程式表示)
(1)光导纤维 (1分)
(2)5、8 H+、5、4 H2O (2分);0.4mol(各2分)
(3)使溶液中的Fe3+完全沉淀(2分)
(4)MnO2(1分) 2 MnO4- +3Mn2+ +2H2O=5MnO2+4 H+(2分)
(5)Al3++3H2O Al(OH)3+3 H+(2分)
Al(OH)3+3 H+(2分)
(2)5、8 H+、5、4 H2O (2分);0.4mol(各2分)
(3)使溶液中的Fe3+完全沉淀(2分)
(4)MnO2(1分) 2 MnO4- +3Mn2+ +2H2O=5MnO2+4 H+(2分)
(5)Al3++3H2O
 Al(OH)3+3 H+(2分)
Al(OH)3+3 H+(2分)试题分析:(1)二氧化硅不与酸反应,所以滤渣a中有二氧化硅,二氧化硅可以做光导纤维;
(2)锰元素作为氧化剂由+7价被还原为+2价,亚铁离子作为还原剂由+2价被氧化为+3价;
(3)三价铁离子在PH接近3时会完全沉淀;
(4)双氧水在二氧化锰做催化剂的条件下放出氧气;
(5)铝离子水解所以呈酸性。

练习册系列答案
相关题目