题目内容
氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是( )
| A.一个D2O分子所含的中子数为8 | B.NH3的结构式为H—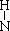 —H —H |
C.HCl的电子式为H+[ ] ] | D.热稳定性:H2S>HI |
B
考查的知识点:原子结构、物质结构、元素周期律
A:氢元素有三种常见同位素:H((1H)、D(21H)、T(31H);D2O的中子数为
(2-1)×2+(16-8)=10。所以A错
B:结构式可以从电子式去演变,也可以根据各原子形成的共价键个数去书写
N原子形成三个共价键,H原子形成一个共价键,所以NH3的结构式为H—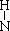 —H
—H
是正确的
C、书写电子式之前一定要先判断是离子键还是共价键
判断的原理:一般金属与非金属元素间形成离子键,除了AlCl3等
一般非金属元素与非金属元素间形成共价键,除了铵盐等
从上可知,HCl中H和Cl之间形成的是共价键而非离子键,正确的电子式为H
所以C错
D、元素的非金属性越强,气态氢化物越稳定。由非金属活动性顺序表
F、Cl、Br、I、S(从F到S,元素的非金属性逐渐减弱)可知:
非金属性:I> S
氢化物的稳定性:HI > H2S ,所以D错误
A:氢元素有三种常见同位素:H((1H)、D(21H)、T(31H);D2O的中子数为
(2-1)×2+(16-8)=10。所以A错
B:结构式可以从电子式去演变,也可以根据各原子形成的共价键个数去书写
N原子形成三个共价键,H原子形成一个共价键,所以NH3的结构式为H—
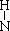 —H
—H是正确的
C、书写电子式之前一定要先判断是离子键还是共价键
判断的原理:一般金属与非金属元素间形成离子键,除了AlCl3等
一般非金属元素与非金属元素间形成共价键,除了铵盐等
从上可知,HCl中H和Cl之间形成的是共价键而非离子键,正确的电子式为H

所以C错
D、元素的非金属性越强,气态氢化物越稳定。由非金属活动性顺序表
F、Cl、Br、I、S(从F到S,元素的非金属性逐渐减弱)可知:
非金属性:I> S
氢化物的稳定性:HI > H2S ,所以D错误

练习册系列答案
相关题目