题目内容
捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。
目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g) (NH4)2CO3(aq)
△H1
(NH4)2CO3(aq)
△H1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g) (NH4)2HCO3(aq) △H2
(NH4)2HCO3(aq) △H2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g) 2(NH4)2HCO3(aq) △H3
2(NH4)2HCO3(aq) △H3
请回答下列问题:
(1)△H3与△H1、△H2之间的关系是:△H3 。
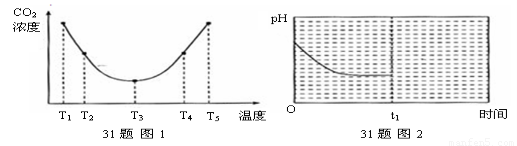
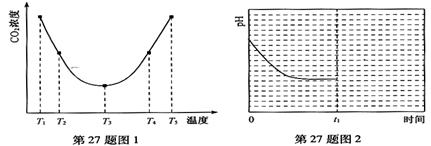
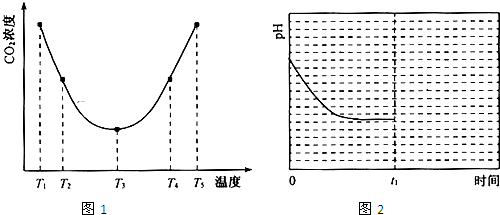
(2)为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其它初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,得到趋势图(见图1)。则:
①△H3 0(填>、=或<)。
②在T1~T2及T4~T5二个温度区间,容器内CO2气体浓度呈现如图1所示的变化趋势,
其原因是 。
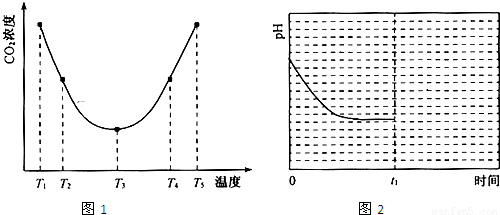
③反应Ⅲ在温度为T1时,溶液pH随时间变化的趋势曲线如图2所示。当时间到达t1时,将该反应体系温度上升到T2,并维持该温度。请在图中画出t1时刻后溶液的pH变化总趋势曲线。
(3)利用反应Ⅲ捕获CO2,在(NH4)2CO3初始浓度和体积确定的情况下,提高CO2吸收量的措施有 (写出2个)。
(4)下列物质中也可能作为CO2捕获剂的是 。
A.NH4Cl B.Na2CO3
C.HOCH2CH2OH D.HOCH2CH2NH2
(1)2△H2-△H1
(2)①<
②T1-T2区间,化学反应未达到平衡,温度越高,化学反应的速率越快,所以CO2被捕获的量随温度升高而提高。T4-T5区间,化学反应已达到平衡,由于正反应是放热反应,温度升高平衡向逆反应方向移动,所以不利于CO2的捕获。
③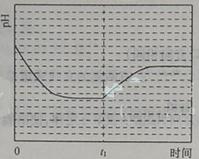
(3)降低温度;增加CO2浓度(或分压)
(4)B、D
【解析】
(1)将反应Ⅰ倒过来书写:
(NH4)2CO3 (aq)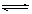 2NH3 (l)+ H2O (l)+ CO2
(g) —△H1
2NH3 (l)+ H2O (l)+ CO2
(g) —△H1
将反应Ⅱ×2:
2NH3 (l)+ 2H2O (l)+ 2CO2
(g)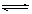 2NH4HCO3
(aq) 2△H2
2NH4HCO3
(aq) 2△H2
得:(NH4)2CO3
(aq) + H2O (l)+ CO2 (g)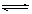 2NH4HCO3 (aq)
△H3 =2△H2—△H1
2NH4HCO3 (aq)
△H3 =2△H2—△H1
(2)由图1可知:在温度为T3时反应达平衡,此后温度升高,c(CO2)增大,平衡逆向移动,说明反应Ⅲ是放热反应(△H3<0)。在T3前反应未建立平衡,无论在什么温度下(NH4)2CO3 (aq)总是捕获CO2,故c(CO2)减小。反应Ⅲ在温度为T1时建立平衡后(由图2可知:溶液pH不随时间变化而变化),迅速上升到T2并维持温度不变,平衡逆向移动,溶液pH增大,在T2时又建立新的平衡。
(3)根据平衡移动原理,降低温度或增大c(CO2)
(4)具有碱性的物质均能捕获CO2,反应如下:Na2CO3 +CO2 +H2O=2NaHCO3;HOCH2CH2NH2 +CO2 +H2O= HOCH2CH2NH3+ HCO3—。
【考点定位】考查热化学方程式书写,化学反应速率、化学平衡移动和化学方程式书写等。

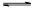 (NH4)2CO3(aq) △H1
(NH4)2CO3(aq) △H1