题目内容
(2013?浙江)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用.目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)?(NH4)2CO3(aq)△H1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)?(NH4)2HCO3(aq)△H2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)?2(NH4)2HCO3(aq)△H3
请回答下列问题:
(1)△H3与△H1、△H2之间的关系是:△H3=
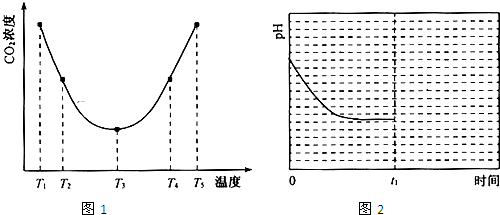
(2)为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度.然后分别在温度为T2、T3、T4、T5下,保持其它初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,得到趋势图(见图1).则:
①△H3
②在T1~T2及T4~T5二个温度区间,容器内CO2气体浓度呈现如图1所示的变化趋势,其原因是
③反应Ⅲ在温度为T1时,溶液pH随时间变化的趋势曲线如图2所示.当时间到达t1时,将该反应体系温度上升到T2,并维持该温度.请在图中画出t1时刻后溶液的pH变化总趋势曲线.
(3)利用反应Ⅲ捕获CO2,在(NH4)2CO3初始浓度和体积确定的情况下,提高CO2吸收量的措施有
(4)下列物质中也可能作为CO2捕获剂的是
A.NH4Cl B.Na2CO3 C.HOCH2CH2OH D.HOCH2CH2NH2.
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)?(NH4)2CO3(aq)△H1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)?(NH4)2HCO3(aq)△H2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)?2(NH4)2HCO3(aq)△H3
请回答下列问题:
(1)△H3与△H1、△H2之间的关系是:△H3=
2△H2-△H1
2△H2-△H1
.(2)为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度.然后分别在温度为T2、T3、T4、T5下,保持其它初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,得到趋势图(见图1).则:
①△H3
<
<
0(填>、=或<).②在T1~T2及T4~T5二个温度区间,容器内CO2气体浓度呈现如图1所示的变化趋势,其原因是
T1-T2区间,化学反应未达到平衡状态,温度越高,化学反应速率越快,所以CO2被捕获的量随着温度的升高而提高.T3-T4区间,化学反应已达到平衡状态,由于正反应为放热反应,温度升高平衡向逆反应方向移动,所以不利于CO2的捕获
T1-T2区间,化学反应未达到平衡状态,温度越高,化学反应速率越快,所以CO2被捕获的量随着温度的升高而提高.T3-T4区间,化学反应已达到平衡状态,由于正反应为放热反应,温度升高平衡向逆反应方向移动,所以不利于CO2的捕获
.③反应Ⅲ在温度为T1时,溶液pH随时间变化的趋势曲线如图2所示.当时间到达t1时,将该反应体系温度上升到T2,并维持该温度.请在图中画出t1时刻后溶液的pH变化总趋势曲线.

(3)利用反应Ⅲ捕获CO2,在(NH4)2CO3初始浓度和体积确定的情况下,提高CO2吸收量的措施有
降低温度;增大CO2浓度
降低温度;增大CO2浓度
(写出2个).(4)下列物质中也可能作为CO2捕获剂的是
B、D
B、D
.A.NH4Cl B.Na2CO3 C.HOCH2CH2OH D.HOCH2CH2NH2.
分析:(1)利用盖斯定律计算;
(2)①温度升高,c(CO2)增大,平衡逆向移动,说明反应Ⅲ是放热反应(△H3<0);②T1-T2区间,化学反应未达到平衡状态,温度越高,化学反应速率越快,所以CO2被捕获的量随着温度的升高而提高.T3-T4区间,化学反应已达到平衡状态,由于正反应为放热反应,温度升高平衡向逆反应方向移动,所以不利于CO2的捕获
③反应Ⅲ在温度为T1时建立平衡后(由图2可知:溶液pH不随时间变化而变化),迅速上升到T2并维持温度不变,平衡逆向移动,溶液pH增大,在T2时又建立新的平衡;
(3)根据平衡移动原理分析;
(4)具有碱性的物质均能捕获CO2.
(2)①温度升高,c(CO2)增大,平衡逆向移动,说明反应Ⅲ是放热反应(△H3<0);②T1-T2区间,化学反应未达到平衡状态,温度越高,化学反应速率越快,所以CO2被捕获的量随着温度的升高而提高.T3-T4区间,化学反应已达到平衡状态,由于正反应为放热反应,温度升高平衡向逆反应方向移动,所以不利于CO2的捕获
③反应Ⅲ在温度为T1时建立平衡后(由图2可知:溶液pH不随时间变化而变化),迅速上升到T2并维持温度不变,平衡逆向移动,溶液pH增大,在T2时又建立新的平衡;
(3)根据平衡移动原理分析;
(4)具有碱性的物质均能捕获CO2.
解答:解:(1)将反应Ⅰ倒过来书写:
(NH4)2CO3 (aq)?2NH3 (l)+H2O (l)+CO2 (g)-△H1
将反应Ⅱ×2:
2NH3 (l)+2H2O (l)+2CO2 (g)?2NH4HCO3 (aq) 2△H2
得:(NH4)2CO3 (aq)+H2O (l)+CO2 (g)?2NH4HCO3 (aq)△H3=2△H2-△H1 ;
故答案为:2△H2-△H1;
(2)①由图1可知:在温度为T3时反应达平衡,此后温度升高,c(CO2)增大,平衡逆向移动,说明反应Ⅲ是放热反应△H3<0;
②在T3前反应未建立平衡,无论在什么温度下(NH4)2CO3 (aq)总是捕获CO2,故c(CO2)减小;
③反应Ⅲ在温度为T1时建立平衡后(由图2可知:溶液pH不随时间变化而变化),迅速上升到T2并维持温度不变,平衡逆向移动,溶液pH增大,在T2时又建立新的平衡,图象应为,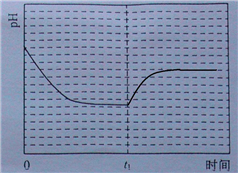 ;
;
故答案为:①<;
②T1-T2区间,化学反应未达到平衡,温度越高,化学反应的速率越快,所以CO2被捕获的量随温度升高而提高.T4-T5区间,化学反应已达到平衡,由于正反应是放热反应,温度升高平衡向逆反应方向移动,所以不利于CO2的捕获.
③
(3)根据平衡移动原理,降低温度或增大c(CO2),故答案为:降低温度;增大CO2浓度
(4)具有碱性的物质均能捕获CO2,反应如下:Na2CO3+CO2+H2O=2NaHCO3;HOCH2CH2NH2+CO2+H2O=HOCH2CH2NH3+ HCO3-;故答案为B、D.
(NH4)2CO3 (aq)?2NH3 (l)+H2O (l)+CO2 (g)-△H1
将反应Ⅱ×2:
2NH3 (l)+2H2O (l)+2CO2 (g)?2NH4HCO3 (aq) 2△H2
得:(NH4)2CO3 (aq)+H2O (l)+CO2 (g)?2NH4HCO3 (aq)△H3=2△H2-△H1 ;
故答案为:2△H2-△H1;
(2)①由图1可知:在温度为T3时反应达平衡,此后温度升高,c(CO2)增大,平衡逆向移动,说明反应Ⅲ是放热反应△H3<0;
②在T3前反应未建立平衡,无论在什么温度下(NH4)2CO3 (aq)总是捕获CO2,故c(CO2)减小;
③反应Ⅲ在温度为T1时建立平衡后(由图2可知:溶液pH不随时间变化而变化),迅速上升到T2并维持温度不变,平衡逆向移动,溶液pH增大,在T2时又建立新的平衡,图象应为,
 ;
; 故答案为:①<;
②T1-T2区间,化学反应未达到平衡,温度越高,化学反应的速率越快,所以CO2被捕获的量随温度升高而提高.T4-T5区间,化学反应已达到平衡,由于正反应是放热反应,温度升高平衡向逆反应方向移动,所以不利于CO2的捕获.
③

(3)根据平衡移动原理,降低温度或增大c(CO2),故答案为:降低温度;增大CO2浓度
(4)具有碱性的物质均能捕获CO2,反应如下:Na2CO3+CO2+H2O=2NaHCO3;HOCH2CH2NH2+CO2+H2O=HOCH2CH2NH3+ HCO3-;故答案为B、D.
点评:考查热化学方程式书写,化学反应速率、化学平衡移动和化学方程式书写等,题目综合性较强.

练习册系列答案
相关题目