题目内容
【题目】资料显示:“氨气可在纯氧中安静燃烧…”.某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验.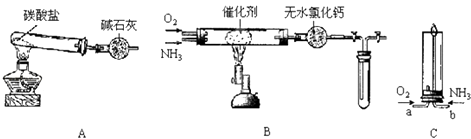
回答下列问题.
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是;碱石灰的作用是 .
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:①氨催化氧化的化学方程式是;
②试管内气体变为红棕色,该反应的化学方程式是 .
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气,可观察到氨气安静燃烧,此外无其它明显现象.①两气体通入的先后顺序是 , 其理由是 .
②由实验现象可知,氨气燃烧的化学方程式是 .
【答案】
(1)(NH4)2CO3(或NH4HCO3);吸收水和二氧化碳
(2)4NH3+5O2 ![]() 4NO+6H2O;2NO+O2=2NO2
4NO+6H2O;2NO+O2=2NO2
(3)先通入O2 , 后通入NH3;若先通氨气,氨在空气中不能点燃,逸出造成污染;4NH3+3O2 ![]() 2N2+6H2O
2N2+6H2O
【解析】解:(1)碳酸盐加热分解能产生NH3 , 只有(NH4)2CO3或NH4HCO3 , 其分解产生的混合气体通过碱石灰后,CO2和H2O被吸收,可得到纯净的NH3;所以答案是:(NH4)2CO3(或NH4HCO3);吸收水和二氧化碳;(2)①NH3与过量O2在催化剂、加热条件下发生反应:4NH3+5O2 ![]() 4NO+6H2O;所以答案是:所以答案是:4NH3+5O2
4NO+6H2O;所以答案是:所以答案是:4NH3+5O2 ![]() 4NO+6H2O;②通过无水CaCl2后,未反应完的NH3和生成的H2O被吸收,生成的NO在试管内被过量的O2氧化为红棕色的NO2气体,方程式为:2NO+O2═2NO2;所以答案是:2NO+O2═2NO2;(3)①由于装置C上端开口,要点燃NH3 , 须先通入O2 , 后通入NH3 , 因为若先通入NH3 , NH3在空气中不能点燃,NH3逸出会造成污染;所以答案是:先通入O2 , 后通入NH3 , 若先通氨气,氨在空气中不能点燃,逸出造成污染;②NH3在纯氧中燃烧的化学方程式为:4NH3+3O2
4NO+6H2O;②通过无水CaCl2后,未反应完的NH3和生成的H2O被吸收,生成的NO在试管内被过量的O2氧化为红棕色的NO2气体,方程式为:2NO+O2═2NO2;所以答案是:2NO+O2═2NO2;(3)①由于装置C上端开口,要点燃NH3 , 须先通入O2 , 后通入NH3 , 因为若先通入NH3 , NH3在空气中不能点燃,NH3逸出会造成污染;所以答案是:先通入O2 , 后通入NH3 , 若先通氨气,氨在空气中不能点燃,逸出造成污染;②NH3在纯氧中燃烧的化学方程式为:4NH3+3O2 ![]() 2N2+6H2O;所以答案是:4NH3+3O2
2N2+6H2O;所以答案是:4NH3+3O2 ![]() 2N2+6H2O;
2N2+6H2O;