题目内容
【题目】二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。制备ClO2的方法有多种,其中一种方法的化学方程式如下:
2 NaClO3 + H2O2 + H2SO4=2 ClO2↑+ O2↑+Na2SO4 + 2 H2O
(1)该反应的还原剂是 ,若反应中有0.1mol电子转移,则产生的ClO2气体在标准状况下的体积为 L;
(2)用双线桥法在下面的反应式上标出电子转移的方向与数目。
2 NaClO3 + H2O2 + H2SO4=2 ClO2↑+ O2↑+ Na2SO4 + 2 H2O(3)某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO—与ClO3—的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为 ;
【答案】
(1)H2O2;2.24 ;
(2) ;
;
(3)4:1
【解析】
试题分析:(1)2 NaClO3 + H2O2 + H2SO4=2 ClO2↑+ O2↑+Na2SO4 + 2 H2O反应中,氯元素化合价由+5价变为+4价,被还原,NaClO3是氧化剂,氧元素化合价由-1价变为0价,被氧化,H2O2是还原剂,若反应中有0.1mol电子转移,则产生的ClO2的物质的量为0.1mol,在标准状况下的体积为2.24L,故答案为:H2O2;2.24;
(2)2 NaClO3 + H2O2 + H2SO4=2 ClO2↑+ O2↑+ Na2SO4 + 2 H2O反应中NaClO3是氧化剂,H2O2是还原剂,分析如下: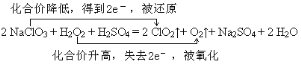 ,故答案为:
,故答案为: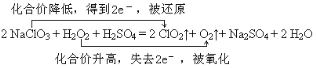 ;
;
(3)Cl2和NaOH发生氧化还原反应生成NaCl、NaClO、NaClO3时,Cl2既是氧化剂又是还原剂,如果混合溶液中c(ClO-):c(ClO3-)=1:3,设c(ClO-)、c(ClO3-)的物质的量浓度分别是1mol/L、3mol/L,根据转移电子守恒计算c(NaCl)=![]() =16mol/L,所以被还原的Cl元素和被氧化的Cl元素就是生成KCl的氯元素和生成KClO、KClO3的Cl元素,溶液体积相等,所以被还原的Cl元素和被氧化的Cl元素的物质的量之比为16:(1+3)=4:1,故答案为:4:1。
=16mol/L,所以被还原的Cl元素和被氧化的Cl元素就是生成KCl的氯元素和生成KClO、KClO3的Cl元素,溶液体积相等,所以被还原的Cl元素和被氧化的Cl元素的物质的量之比为16:(1+3)=4:1,故答案为:4:1。

