题目内容
【题目】已知亚硫酸为二元中强酸,不稳定,易被氧化。请回答下列问题:
(1)下列有关亚硫酸的性质的判断正确的是______(填标号)。
a.具有酸性 b.具有氧化性 c.具有还原性 d.有刺激性气味
(2)亚硫酸在水中电离的方程式为______________________。
(3)将亚硫酸钠(Na2SO3)溶液滴人到几种不同溶液中的现象如下表所示:
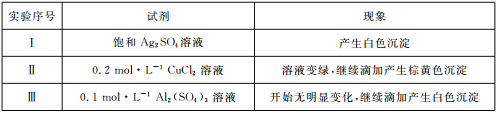
①经检验,实验I中的白色沉淀是Ag2SO3。用离子方程式解释:__________________。
②经检验,实验Ⅱ中的棕黄色沉淀中不含SO42-,含有Cu+、Cu2+和SO32-。推测反应后的溶液中一定含有溶质电离出的阴离子是______________,请选用合适的试剂分别验证这些离子:________________。
③已知:Al2(SO3)3在水溶液中不存在。经检验,实验Ⅲ中的白色沉淀中无SO2,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色。推测沉淀中含有的阴离子为_______。
【答案】(1) abcd;(2) H2SO3![]() H++HSO3-、HSO3-
H++HSO3-、HSO3-![]() H++ SO32-;(3)①2Ag++SO32-=Ag2SO3↓; ②SO42-、Cl-,取少量滤液,用足量盐酸酸化后滴加氯化钡溶液,有白色沉淀生成,证明含SO42-;另取少量滤液,用足量硝酸酸化后滴加足量硝酸钡溶液,过滤,向所得滤液中滴加硝酸银溶液,有白色沉淀生成,证明含Cl-;③SO32-、OH-。
H++ SO32-;(3)①2Ag++SO32-=Ag2SO3↓; ②SO42-、Cl-,取少量滤液,用足量盐酸酸化后滴加氯化钡溶液,有白色沉淀生成,证明含SO42-;另取少量滤液,用足量硝酸酸化后滴加足量硝酸钡溶液,过滤,向所得滤液中滴加硝酸银溶液,有白色沉淀生成,证明含Cl-;③SO32-、OH-。
【解析】
试题分析:(1)a、亚硫酸是二元中强酸,具有酸性,故正确;b、亚硫酸中S显+4价,处于中间价态,具有氧化性,故正确;c、根据b的分析,故正确;d、亚硫酸不稳定,易分解成SO2,因此具有刺激性气味,故正确;(2)亚硫酸是二元中强酸,H2SO3![]() H++HSO3-,HSO3-
H++HSO3-,HSO3-![]() H++SO32-;(3)①根据信息,2Ag++SO32-=Ag2SO3↓;②根据反应元素守恒,溶液中含有阴离子有:Cl-, 沉淀中不含SO42-,说明溶液中含有SO42-,取少量滤液,用足量盐酸酸化后滴加氯化钡溶液,有白色沉淀生成,证明含SO42-;另取少量滤液,用足量硝酸酸化后滴加足量硝酸钡溶液,过滤,向所得滤液中滴加硝酸银溶液,有白色沉淀生成,证明含Cl-;③沉淀能使酸性高锰酸钾溶液褪色,说明含还原性离子存在,因此沉淀中含有SO32-,能溶于强酸,说明含有OH-,能溶于碱,说明含有Al3+。
H++SO32-;(3)①根据信息,2Ag++SO32-=Ag2SO3↓;②根据反应元素守恒,溶液中含有阴离子有:Cl-, 沉淀中不含SO42-,说明溶液中含有SO42-,取少量滤液,用足量盐酸酸化后滴加氯化钡溶液,有白色沉淀生成,证明含SO42-;另取少量滤液,用足量硝酸酸化后滴加足量硝酸钡溶液,过滤,向所得滤液中滴加硝酸银溶液,有白色沉淀生成,证明含Cl-;③沉淀能使酸性高锰酸钾溶液褪色,说明含还原性离子存在,因此沉淀中含有SO32-,能溶于强酸,说明含有OH-,能溶于碱,说明含有Al3+。