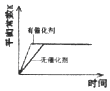
ΧβΡΩΡΎ»ί
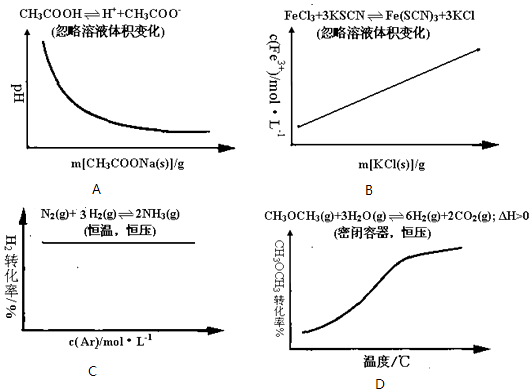
ΓΨΧβΡΩΓΩpH‘Ύ±μ Ψ»ή“ΚΒΡΥαΦν–‘ΖΫΟφ”–÷Ί“ΣΒΡ”Π”ΟΘ§«κΑ¥“Σ«σΆξ≥…ΧνΩ’
Θ®1Θ©≥ΘΈ¬œ¬Θ§pH=12ΒΡNaOH»ή“ΚΒΡΤδ≈®Ε»cΘ®NaOHΘ©=mol/L
Θ®2Θ©≥ΘΈ¬œ¬Θ§Ρ≥“Μ‘Σ»θΥα»ή“ΚΒΡpH=1Θ§Τδ≈®Ε»0.1mol/LΘ®ΧνΓΑΘΨΓ±ΓΔΓΑΘΦΓ±ΜρΓΑ=Γ±Θ©ΘΜ
Θ®3Θ©≥ΘΈ¬œ¬Θ§ΫΪ100mL 0.1mol/L¥ΉΥα»ή“ΚΚΆ50mL 0.2mol/LNaOH»ή“ΚΨυ‘»ΜλΚœΚσΘ§»ή“Κœ‘Θ®ΧνΓΑΥα–‘Γ±ΓΔΓΑΦν–‘Γ±ΜρΓΑ÷––‘Γ±Θ©Θ§Τδ‘≠“ρ «ΘΜΘ®«κ”ΟœύΙΊΒΡάκΉ”ΖΫ≥Χ ΫΉς¥πΘ©
Θ®4Θ©25Γφ ±Θ§»τΧεΜΐΈΣVaΓΔpH=aΒΡΡ≥“Μ‘Σ«ΩΥαHA”κΧεΜΐΈΣVbΓΔpH=bΒΡΡ≥“Μ‘Σ«ΩΦνBOHΜλΚœ«ΓΚΟ÷–ΚΆΘ§«““―÷ΣVaΘΦVbΚΆa=0.5bΘ§‘ρ aΒΡ»Γ÷ΒΖΕΈß « Θ°
ΓΨ¥πΑΗΓΩ
Θ®1Θ©10©¹2mol/L
Θ®2Θ©ΘΨ
Θ®3Θ©Φν–‘ΘΜCH3COO©¹+H2O?CH3COOH+OH©¹
Θ®4Θ©3.5ΘΦaΘΦ ![]()
ΓΨΫβΈωΓΩΫβΘΚΘ®1Θ©≥ΘΈ¬œ¬Θ§pH=12ΒΡNaOH»ή“Κ÷–¥φ‘ΎάκΉ”Μΐ≥Θ ΐΘ§cΘ®H+Θ©cΘ®OH©¹Θ©=10©¹14 Θ§ CΘ®OH©¹Θ©= ![]() =10©¹2mol/LΘ§Τδ≈®Ε»cΘ®NaOHΘ©=10©¹2mol/LΘ§
=10©¹2mol/LΘ§Τδ≈®Ε»cΘ®NaOHΘ©=10©¹2mol/LΘ§
Υυ“‘¥πΑΗ «ΘΚ10©¹2mol/LΘΜ
Θ®2.Θ©≥ΘΈ¬œ¬Θ§Ρ≥“Μ‘Σ»θΥα»ή“Κ÷–¥φ‘ΎΒγάκΤΫΚβΘ§»ή“ΚΒΡpH=1 ««βάκΉ”≈®Ε»ΈΣ0.1mol/LΘ§‘ρΤδ≈®Ε»¥σ”Ύ0.1mol/LΘ§
Υυ“‘¥πΑΗ «ΘΚΘΨΘΜ
Θ®3.Θ©≥ΘΈ¬œ¬Θ§ΫΪ100mL 0.1mol/L¥ΉΥα»ή“ΚΚΆ50mL 0.2mol/LNaOH»ή“ΚΨυ‘»ΜλΚœΚσΘ§¥ΉΥαΈο÷ ΒΡΝΩ=0.1mol/LΓΝ0.1L=0.01molΘ§50mL 0.2mol/LNaOH»ή“Κ÷–»ή÷ Έο÷ ΒΡΝΩ=0.050LΓΝ0.2mol/L=0.01molΘ§Εΰ’Ώ«ΓΚΟΆξ»ΪΖ¥”Π…ζ≥…¥ΉΥαΡΤΘ§¥ΉΥαΗυάκΉ” ß»θΥα“θάκΉ”Θ§Υ°»ή“Κ÷–Υ°Ϋβœ‘Φν–‘Θ§CH3COO©¹+H2OCH3COOH+OH©¹ Θ§
Υυ“‘¥πΑΗ «ΘΚΦν–‘ΘΜCH3COO©¹+H2OCH3COOH+OH©¹ΘΜ
Θ®4.Θ©ΥαΓΔΦνΕΦ «“Μ‘Σ«ΩΒγΫβ÷ Θ§pH=aΒΡ“Μ‘Σ«ΩΥα»ή“Κ÷–«βάκΉ”≈®Ε»=10©¹a mol/LΘ§pH=bΒΡ“Μ‘Σ«ΩΦν÷–«β―θΗυάκΉ”≈®Ε»=10 b©¹14 mol/LΘ§Εΰ’Ώ«ΓΚΟΖ¥”Π ±Θ§ΥαΚΆΦνΒΡΈο÷ ΒΡΝΩœύΒ»Θ§Φ¥ΘΚ
10©¹a mol/LΓΝVaL=10 b©¹14 mol/LΓΝVbLΘ§ ![]()
= ![]() =10 a+b©¹14 Θ§
=10 a+b©¹14 Θ§
VaΘΦVbΘ§
Υυ“‘10 a+b©¹14ΘΦ1Θ§
Υυ“‘a+bΘΦ14Θ§
”÷a=0.5bΘ§
Υυ“‘3aΘΦ14Θ§
Υυ“‘aΘΦ ![]() ΘΜ
ΘΜ
bΘΨ7Θ§a=0.5bΘΨ0.5ΓΝ7=3.5Θ§
Υυ“‘ΒΟΒΫΘΚ3.5ΘΦaΘΦ ![]() Θ§
Θ§
Υυ“‘¥πΑΗ «ΘΚ3.5ΘΦaΘΦ ![]() Θ°
Θ°

 Οϊ–ΘΩΈΧΟœΒΝ–¥πΑΗ
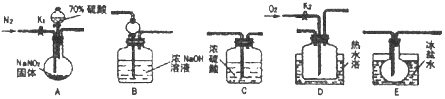
Οϊ–ΘΩΈΧΟœΒΝ–¥πΑΗΓΨΧβΡΩΓΩAΓΔBΓΔCΓΔDΓΔEΓΔFΝυ÷÷ΕΧ÷ήΤΎ‘ΣΥΊΒΡΦρΒΞάκΉ”ΕΦΚ§”–10ΗωΒγΉ”Θ§«“Ε‘”Π‘ΣΥΊΜ·ΚœΦέ”κ‘≠Ή”–ρ ΐΒΡΙΊœΒ»γΆΦΥυ ΨΓΘ
Θ®1Θ©ΫΪAΓΔEΝΫ÷÷‘ΣΥΊΒΡ‘ΣΥΊΖϊΚ≈Χν»κœ¬±μ÷–’ΐ»ΖΒΡΈΜ÷Ο…œΓΘ________
Ήε–ρ ΐ ÷ήΤΎ | IA | ΔρA | ΔσA | ΔτA | ΔθA | ΔωA | ΔςA | 0 |
“Μ | ||||||||
Εΰ | ||||||||
»ΐ | ||||||||
Θ®2Θ©AΓΔBΓΔCΓΔDΓΔEΓΔFΝυ÷÷‘ΣΥΊ÷–Ζ«Ϋπ τ–‘Ήν«ΩΒΡ «____________(Χν‘ΣΥΊΖϊΚ≈)Θ§BΓΔDΝΫ‘ΣΥΊΩ…“‘Ήι≥…‘≠Ή”Ηω ΐ±»ΈΣ1ΘΚ1ΒΡάκΉ”Μ·ΚœΈοΘ§–¥≥ωΗΟάκΉ”Μ·ΚœΈοΒΡΒγΉ” ΫΘΚ______Θ§AΓΔBΝΫ‘ΣΥΊΕ‘”ΠΒΡΤχΧ§«βΜ·ΈοΒΡΈ»Ε®–‘«Ω»θΙΊœΒ «________________(”ΟΜ·―ß Ϋ±μ Ψ)ΓΘ
Θ®3Θ©–¥≥ωDΓΔFΝΫ‘ΣΥΊΒΡΉνΗΏΦέ―θΜ·ΈοΕ‘”ΠΒΡΥ°Μ·ΈοΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΘΚ________________________
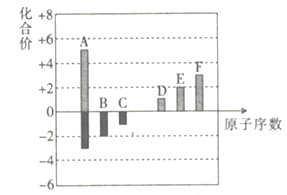
ΓΨΧβΡΩΓΩ‘ΣΥΊ÷ήΤΎ±μ”κ‘ΣΥΊ÷ήΤΎ¬…‘Ύ―ßœΑΓΔ―–ΨΩΚΆ…ζ≤ζ ΒΦυ÷–”–Κή÷Ί“ΣΒΡΉς”ΟΓΘœ¬±μΝ–≥ωΝΥΔΌΓΪΔαΨ≈÷÷‘ΣΥΊ‘Ύ÷ήΤΎ±μ÷–ΒΡΈΜ÷ΟΓΘ
Ήε ÷ήΤΎ | ΔώA | ΔρA | ΔσA | ΔτA | ΔθA | ΔωA | ΔςA | 0 |
2 | Δί | Δό | ΔΏ | |||||
3 | ΔΎ | Δέ | Δή | Δύ | Δα | |||
4 | ΔΌ |
«κΜΊ¥πΘΚ
Θ®1Θ©’βΨ≈÷÷‘ΣΥΊ÷–Μ·―ß–‘÷ Ήν≤ΜΜνΤΟΒΡ «________ΓΘ(Χν‘ΣΥΊΖϊΚ≈)
Θ®2Θ©–¥≥ωΔή‘ΣΥΊΒΞ÷ ΒΡ“Μ÷÷”ΟΆΨ_____________________ΓΘ
Θ®3Θ©–¥≥ωΔύ‘ΣΥΊΉνΗΏΦέ―θΜ·ΈοΕ‘”ΠΥ°Μ·ΈοΒΡΜ·―ß Ϋ______________________ΓΘ
Θ®4Θ©–¥≥ωΔΎΓΔΔύ‘ΣΥΊ–Έ≥…ΒΡΜ·ΚœΈοΒΡΒγΉ” Ϋ______________________ΓΘ
Θ®5Θ©‘ΎΔΌΓΔΔΎΓΔΔέ»ΐ÷÷‘ΣΥΊΒΡΉνΗΏΦέ―θΜ·ΈοΕ‘”ΠΒΡΥ°Μ·Έο÷–Θ§Φν–‘Ήν«ΩΒΡ «_______________(ΧνΜ·―ß Ϋ)ΓΘ
Θ®6Θ© ΔήΓΔΔίΓΔΔό»ΐ÷÷‘ΣΥΊΑ¥‘≠Ή”ΑκΨΕ”…¥σΒΫ–ΓΒΡΥ≥–ρ“ά¥ΈΈΣ___________(Χν‘ΣΥΊΖϊΚ≈)ΓΘ
Θ®7Θ©ΔέΓΔΔόΓΔΔΏΥΡ÷÷‘ΣΥΊΒΡΦρΒΞάκΉ”ΑκΨΕ”…¥σΒΫ–ΓΒΡΥ≥–ρ“ά¥ΈΈΣ___________(ΧνάκΉ”ΖϊΚ≈)ΓΘ